Introduction
Anatomie de l'hippocampe
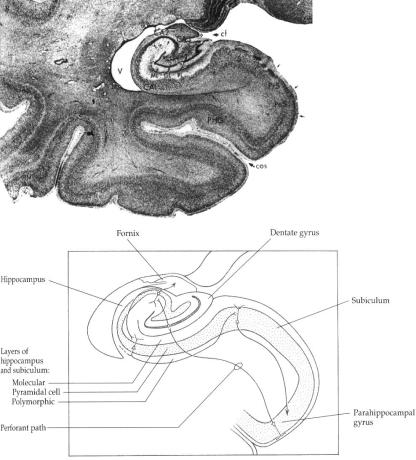
Chez les mammifères supérieurs, l'hippocampe est une petite structure sous-corticale enroulée sur elle-même et occupant la face médiane du lobe temporal (Fig. 1A). Situé légèrement en profondeur et saillant dans le ventricule latéral, il est recouvert en grande partie par la circonvolution parahippocampale à laquelle il est relié par le subiculum et le cortex entorhinal. Attaché à la face dorsale de l'hippocampe se trouve un ruban épais de fibres, la fimbria de l'hippocampe, qui constitue le fornix et se termine au niveau du corps mamillaire. Connectées à l'amygdale, au septum et au thalamus, ces structures constituent les éléments principaux du système limbique, jouant un rôle fondamental dans l'apprentissage et les émotions (Fig. 1B).

Structure interne
En coupe transversale, on peut observer que l'hippocampe est formé de deux structures en forme de U inversés (Fig. 2), le gyrus denté et la corne d'Ammon (Cajal 1911, Lorente de No 1934 ). Sur la base de différences morphologiques et de ses connexions synaptiques, la corne d'Ammon est encore subdivisée en trois parties : CA3, CA2 et CA1. Au lieu des 6 couches cellulaires principales du néocortex, l'hippocampe en contient 5 : L'alveus, contenant les axones des cellules pyramidales dirigées vers la fimbria ou le subiculum, le stratum oriens, situé entre l'alveus et les cellules pyramidales et contenant les dendrites basales de ces dernières, ainsi que des cellules en corbeille et quelques afférences du septum.


Le stratum pyramidale, contient les corps cellulaires des cellules pyramidales de la corne d'Ammon et les stratum radiatum et stratum lacunosum/moleculare en contiennent les segments respectivement proximaux et distaux de l'arbre dendritique apical. Dans le CA3, une couche supplémentaire est reconnue : le stratum lucidum, situé entre les stratum pyramidale et stratum radiatum, recevant les fibres moussues des cellules granulaires. Dans le gyrus denté, par contre, on distingue 3 couches : le stratum granulosum, contenant les corps cellulaires des cellules granulaires, la couche moléculaire, formée par les dendrites apicales des cellules granulaires et leurs afférences et enfin la couche polymorphique, formée par les segments initiaux des axones des cellules granulaires alors qu'elles se rassemblent pour donner naissance aux fibres moussues, ainsi que par quelques cellules en corbeille.

Différents types de cellules sont présents dans l'hippocampe, comme dans la majorité du système nerveux central. Les cellules ayant la plus évidente importance physiologique sont les neurones pyramidaux, appelés ainsi à cause de leur forme (Fig. 3). Ce sont des neurones excitateurs glutamatergiques. Ils constituent la majeure partie des cellules du stratum pyramidale de la corne d'Ammon et sont également majoritaires dans diverses régions corticales. Comme nous le verrons plus tard, ils sont en contact avec diverses cellules de l'hippocampe et du cortex. Ces cellules peuvent avoir un diamètre variable. En effet, les neurones pyramidaux du CA3-CA2 sont nettement plus larges et moins condensés que dans le CA1. Dans le gyrus denté, les neurones principaux sont les cellules granulaires. Plus petites et de forme arrondie, elles ne comportent pas de dendrites basales. Les cellules granulaires envoient leurs projections axonales, appelées les fibres moussues, vers le stratum radiatum du CA3.
Environ 12% des neurones hippocampaux sont des cellules dites non-pyramidales (Caeser et al. 1991), c'est à dire n'appartenant ni à la classe des cellules pyramidales, ni aux cellules granulaires. Leur classification est basée sur la localisation et l'apparence de ces cellules, la principale caractéristique morphologique étant que leurs dendrites n'ont pas de processus spinaux. De plus, leur noyau contient des bâtonnets et est entouré d'une membrane nucléaire largement invaginée. On distingue 5 types de cellules non-pyramidales : les cellules en corbeille, situées dans le stratum oriens, les neurones fusiformes, dans la région du hile, les cellules en corbeille de type pyramidal, dans le stratum granulosum du gyrus denté, les cellules bipolaires et multipolaires, principalement situées dans le stratum pyramidale. L'axone des cellules non-pyramidales ne suit pas les voies des fibres intrinsèques et leurs ramifications sont clairement différentes de celles des cellules pyramidales et granulaires. La plupart des cellules non-pyramidales ont été décrites comme des interneurones utilisant le GABA comme neurotransmetteur principal et donc exercant une action inhibitrice sur les réseaux avoisinants. Plusieurs de ces interneurones pourraient également contenir des neuropeptides comme la cholécystokinine (Greenwood et al. 1981), le VIP (Loren et al. 1979) ou encore la substance P (Vincent et al. 1981). Signalons également la présence transitoire de neurones non-pyramidaux appelés cellules de Cajal-Retzius. Encore largement méconnues, ces cellules joueraient un rôle dans l'établissement des premières connexions synaptiques de l'hippocampe avec le cortex entorhinal ainsi que dans la migration neuronale (Del Rio et al. 1997). In vivo, ces cellules disparaissent après environ 3 semaines ou donnent lieu à d'autres cellules non-pyramidales. Certains exemplaires ont néanmoins été retrouvés dans l'hippocampe de patients atteints d'épilepsies du lobe temporal, où elles pourraient participer aux processus de remodelage liés à la lésion (Super et al. 1997).
Quatre types de cellules gliales ont été décrits dans l'hippocampe : les astrocytes, qui représentent environ 75% des cellules non-neuronales (Beach et al. 1982), sont identifiés par la présence de glycogène et d'une protéine, le GFAP (glial fibrillary acid protein) ainsi que par leur morphologie caractéristique : les astrocytes de type I sont des astrocytes fibreux, qui montrent une morphologie de type neuronal par leurs prolongements fins et irréguliers. Les astrocytes de type II sont plus compacts, larges et plats et présentent un cytoplasme plus clair en microscopie électronique. Les astrocytes sont en contact avec les vaisseaux sanguins par leurs filopodes et participent ainsi à la constitution de la barrière hémato-encéphalique. On pense qu'ils jouent également un rôle important dans la nutrition des neurones. Les oligodendrocytes sont de larges cellules avec de longues et fines excroissances excessivement ramifiées. Ils sont impliqués dans la myélinisation des plus grosses fibres axonales. La microglie, largement mobile, impliquée dans la phagocytose d'éventuels déchets cellulaires. Les fibroblastes, cellules de soutien larges et plates, sans excroissance.
Connectivité
Afférences internes
Les principaux neurones de l'hippocampe et du cortex entorhinal sont interconnectés de manière relativement régulière et organisée. Au début des années 1970, il a été proposé que les principales voies excitatrices de l'hippocampe étaient organisées de manière lamellaire le long de 4 groupes de neurones et perpendiculairement à l'axe principal de l'hippocampe (Andersen et al. 1971). Bien que cette organisation lamellaire ne soit que partielle et que des connexions excitatrices et inhibitrices transverses puissent jouer un rôle fonctionnel important, il semble que d'étroites bandes de cortex hippocampal puissent opérer comme des unités fonctionnelles indépendantes. Cette particularité fait de l'hippocampe un modèle intéressant pour des études fonctionnelles in vitro, sur des tranches fraîchement disséquées comme sur des cultures organotypiques (Fig. 4A).
Le flux d'informations à travers l'hippocampe est unidirectionnel. Le circuit le plus simple est constitué d'une voie principale excitatrice trisynaptique mettant en jeu 4 groupes de neurones : les cellules pyramidales du cortex entorhinal envoient leurs axones, formant la voie perforante, vers le gyrus denté pour contacter les cellules granulaires. Les axones des cellules granulaires, les fibres moussues, contactent les cellules pyramidales du CA3 qui, à leur tour, envoient des axones, appelés les collatérales de Schaffer, à travers le stratum pyramidale vers l'aire du CA1. Ces derniers neurones envoient leurs projections hors de l'hippocampe, vers le subiculum qui contacte en retour le cortex entorhinal, formant ainsi une boucle anatomique. Outre cette voie trisynaptique, d'autres régions de l'hippocampe sont également contactées par le cortex entorhinal, telles que le CA1 et le CA3, ainsi que le subiculum.
Afférences externes
L'hippocampe reçoit des afférences de 4 régions principales : l'hippocampe controlatéral, le cortex entorhinal, l'aire du septum médian et différents sites du tronc cérébral.
Les afférences commissurales, comme on appelle les différentes connexions entre l'hippocampe gauche et l'hippocampe droit, se font par l'intermédiaire de fibres courant le long de la fimbria. Il existe une certaine spécificité homotopique des connexions entre les deux sites : le CA3 projette vers le CA3, le CA1 antérieur vers le CA1 antérieur, le CA1 postérieur, par contre, ainsi que le gyrus denté, reçoivent des afférences non-homotopiques du CA3.
Les afférences émanant du cortex entorhinal font principalement partie de la voie perforante (Fig. 4B). Cette dernière est issue du cortex entorhinal latéral, traverse le subiculum puis pénètre soit directement dans la corne d'Ammon ou perfore la fissure hippocampale vers le gyrus denté. Une faible proportion des afférences entorhinales sont controlatérales. Ces connexions sont organisées de manière topographique. En effet, une cellule granulaire est contactée à des niveaux différents de son arborisation dendritique selon l'origine des afférences. Elle peut ainsi déterminer d'où vient son afférence selon quelle portion de son arborisation dendritique est connectée. Le cortex entorhinal reçoit des informations de différentes aires corticales : du cortex préfrontal et de la circonvolution du cingulum, du présubiculum, du cortex temporal, des aires pariétales, du cortex pyriforme, des systèmes sensoriels visuel et olfactif, bien que l'importance de cette dernière diminue avec le développement phylogénétique. Enfin, l'amygdale projette vers le cortex entorhinal et le subiculum. Toutes ces sources d'informations sont très spécifiques topographiquement. Ainsi, le cortex prépyriforme contacte l'aire latérale du cortex entorhinal, de même que le cortex orbito-frontal. Le cortex entorhinal peut donc être considéré comme un centre de convergence de modalités sensorielles provenant de différentes aires associatives du néocortex.

Les afférences du tronc cérébral émanent de différentes aires : le noyau médian du Raphé, sérotoninergique, exerce une action inhibitrice sur les cellules pyramidales du CA1, du CA3 et du gyrus denté qu'il contacte via la fimbria. Le locus coeruleus, noradrénergique, influence de manière inhibitrice les zones du stratum lacunosum moleculare des CA1, CA3 et denté qu'il contacte via le cortex retrosplénial.
Les afférences du septum médian, cholinergique, se feraient vraisemblablement via la fimbria et le fornix. Elles connectent les neurones pyramidaux et les interneurones des stratum oriens et radiatum de la corne d'Ammon et du gyrus denté. Ces afférences pourraient être responsables de la genèse du rythme thêta.
Une telle variété des afférences hippocampales suggère que l'hippocampe n'est pas concerné spécifiquement par les informations émanant d'une modalité sensorielle particulière, mais plutôt par des informations hautement analysées, extraites de toutes les modalités.
Efférences hippocampales
La principale voie efférente de l'hippocampe est le fornix (Fig. 4A, 5). Les neurones pyramidaux concentrent leurs axones dans ce faisceau qui projette vers d'autres structures du télencéphale et du diencéphale telles que le noyau accumbens, la formation réticulée, l'aire préoptique, le tronc cérébral. Une telle efférence est représentée par le circuit de Papez : il part du subiculum pour contacter les corps mamillaires de l'hypothalamus, qui connectent le thalamus, puis la circonvolution du cingulum. Cette dernière fournit des informations au cortex entorhinal qui contacte en retour l'hippocampe. Cette boucle anatomique est un élément majeur, avec l'amygdale, du système limbique décrit par Pierre Paul Broca au 19ème siècle comme jouant un rôle important dans les émotions et la mémoire. L'hippocampe contacte également le septum, qui renvoie des projections GABAergiques et cholinergiques sur la formation hippocampale et est supposé jouer un rôle régulateur de l'hippocampe dans certains comportements tels que la reproduction ou la nutrition.
Une autre voie efférente de l'hippocampe part du subiculum qui projette vers le cortex entorhinal qui, à son tour, contacte différentes aires associatives du néocortex telles que le cortex préfrontal, le cortex orbitofrontal, la circonvolution parahippocampale et la circonvolution du cingulum.

Comme on le voit, l'hippocampe se trouve à un carrefour lui donnant accès à des informations spécialisées provenant de différentes modalités sensorielles. Il pourrait ainsi être impliqué dans l'organisation, le triage et la synthèse de ces informations pour influencer en retour des phénomènes endocriniens, viscéraux, moteurs, affectifs et cognitifs. De plus, la force des connections synaptiques dans une partie de ces différents circuits peut être modifiée par l'activité neuronale, indiquant les capacités adaptatives du système. Toutefois, nous ne savons pas encore quelles informations sont modifiées, dans quelle mesure et de quelle manière cette plasticité synaptique aide l'hippocampe à consolider la mémoire à court terme en mémoire à long terme.
Fonction de l'hippocampe
Les anatomistes du début du siècle dernier ont identifié un homologue de l'hippocampe des mammifères dans tous les vertébrés jusqu'au plus primitif d'entre eux, le cyclostome, bien qu'il ne garde pas la même structure dans ces différents organismes. Son rôle varie également selon les espèces, mais il est généralement impliqué dans les processus de mémorisation tels que la mémoire spatiale chez le rat, la mémoire olfactive chez les reptiles ou sémantique chez l'être humain.
Les premières données importantes concernant la fonction de l'hippocampe chez l'être humain sont apparues grâce à l'observation de patients ayant subi des atteintes du cortex hippocampal. Au cours du 19ème siècle, un neuroanatomiste Allemand, Alois Alzheimer, reconnut des modifications morphologiques spécifiquement associées à une forme de démence amnésique. Ces changements étaient les plus notables dans l'hippocampe. Plus tard, vers 1950, les études d'un patient appelé H.M., de l'institut neurologique de Montréal, aboutirent à des observations intéressantes. Souffrant d'une grave épilepsie incurable, H.M. a subi à l'âge de 27 ans une ablation bilatérale des lobes temporaux. Les conséquences de cette ablation furent dramatiques : depuis lors, H.M. souffre d'une très sévère amnésie antérograde. Bien que ses capacités intellectuelles au-dessus de la moyenne ainsi que ses souvenirs antérieurs à l'intervention soient restés intacts, le patient souffre d'une incapacité à retenir de nouvelles informations. De plus, certaines tâches d'apprentissage sont elles aussi restées intactes, telles qu'apprendre à recopier un dessin en regardant sa main dans un miroir alors qu'il ne se souvient pas quand il a appris de tels gestes, ni même d'avoir passé ce test.
Il semble ainsi que l'hippocampe, bien qu'il ne soit pas le siège des souvenirs, joue un rôle critique dans leur formation et plus précisément dans la mémoire des événements, dite mémoire explicite ou déclarative, par opposition à la mémoire de savoir-faire, appelée mémoire implicite ou procédurale, qui dépend d'autres structures du cerveau telles que les ganglions de la base.
Le glutamate
Dans le courant des années 1960, les travaux de Curtis (Curtis 1960) démontrèrent pour la première fois que certains acides aminés tels que l'aspartate et le glutamate (fig. 6A) pouvaient exercer un rôle excitateur sur des neurones de la moelle épinière. Il a ensuite été démontré que l'un d'entre eux, le glutamate, était le principal neurotransmetteur excitateur du système nerveux central (Fonnum et al. 1984). Cet acide aminé répond en effet aux critères de neurotransmetteur : il est localisé dans les vésicules synaptiques (Storm-Mathisen et al. 1979, 1983), une stimulation électrique provoque sa libération de manière calcium-dépendante (Malthe-Sorenssen et al. 1979), il existe une recapture à haute affinité du glutamate au niveau des terminaisons nerveuses (Storm-Mathisen et al. 1975) et il produit une dépolarisation des neurones postsynaptiques en application locale (Dudar et al. 1974, Schwartzkroin et al. 1975). Dans l'hippocampe, il est responsable de la transmission entre les collatérales de Schaffer et les dendrites des cellules pyramidales du CA1, comme le montrent de nombreuses études immunohistochimiques et pharmacologiques (Racca et al. 2000, Hollmann et al. 1994, Takumi et al. 1999).
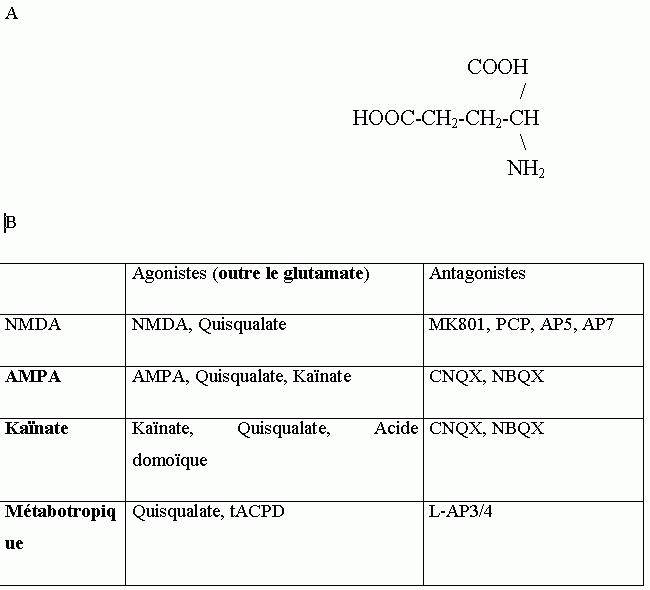
Comme pour d'autres acides aminés tels que le L-aspartate, le L-homocystéate et la L-cystéine sulphinate, l'effet dépolarisant du glutamate est rapide, ce qui suggère qu'il agit sur des récepteurs-canaux. En fait, le glutamate agit sur 2 groupes de récepteurs (fig. 6B) : les récepteurs ionotropiques, qui sont des canaux ioniques dont l'ouverture dépend de la liaison du ligand et les récepteurs métabotropiques, qui sont couplés à une protéine G et une cascade de messagers secondaires.
Récepteurs ionotropiques
Les récepteurs ionotropiques sont classés selon leur sensibilité sélective aux agonistes et antagonistes des acides aminés excitateurs (fig. 6B), leur sensibilité au voltage et leur distribution et ils sont désignés selon le nom de leur agoniste principal. Ainsi trois classes principales de récepteurs-canaux sensibles au glutamate ont été décrites et sont colocalisées sur les mêmes synapses : les récepteurs NMDA (activé par le N-méthyl-D-aspartate), AMPA (activés par le a-amino-3-hydroxy-5-méthyl-4-isoxazolepropionate) et Kaïnate.
Le récepteur Kaïnate
est associé à un canal perméable au potassium, au sodium et au calcium. Il contient deux sites de liaison au kaïnate, d'affinité différente. Il n'existe pas encore d'antagoniste sélectif pour ce récepteur et de plus le récepteur AMPA montre également une faible affinité pour le kaïnate, ce qui explique que ces deux récepteurs ont longtemps été confondus et que le récepteur kaïnate est encore relativement peu connu. 5 sous-unités ont cependant été clonées : 3 sous-unités de faible affinité pour le Kaïnate, GluR5-7 et 2 sous-unités de plus forte affinité pour l'agoniste, KA1-2. Il semble qu'elles soient réparties préférentiellement au niveau présynaptique, dans les fibres moussues par exemple, où elles joueraient un rôle modulateur de la libération du glutamate. Le récepteur kaïnate se retrouve également en forte concentration dans les cellules pyramidales du CA3. Sa fonction exacte reste toutefois encore assez floue : aucune des sous-unités KA1 ou KA2 ne peuvent former de canal fonctionnel. Par contre la sous-unité KA2 semble pouvoir s'associer avec la sous-unité GluR6 pour former un récepteur fonctionnel sensible à l'AMPA alors qu'aucune des deux sous-unités seule ne puisse répondre à cet agoniste (Herb et al. 1992).
Le récepteur AMPA
est associé à un canal perméable principalement aux ions sodium et potassium et est responsable de la transmission synaptique rapide (Mayer et al. 1987, Ascher et al. 1988). Le récepteur serait pentamérique et 4 sous-unités différentes ont été clonées et nommées GluR1-4, qui peuvent se combiner pour former des récepteurs qui pourraient avoir, selon leur composition, des propriétés fonctionnelles différentes. De plus, chacune de ces sous-unités peut exister sous deux formes moléculaires qui diffèrent au niveau d'une région C-terminale : les formes flip et flop, qui sont le résultat d'un épissage alternatif (Sommer et al. 1990). Ces deux formes diffèrent par le taux de désensibilisation au glutamate ainsi que par les amplitudes des courants ainsi activés, mais pas dans leurs propriétés de liaison. Le passage d'une forme à l'autre pourrait constituer un système de régulation postsynaptique des réponses au glutamate et jouer un rôle dans la plasticité synaptique. Notons toutefois que les cellules pyramidales du CA1 de l'hippocampe expriment principalement la forme flop, la plus désensibilisante.
Il a été récemment démontré que les sous-unités du récepteur AMPA ne contiennent pas 4 domaines transmembranaires comme longtemps imaginé, mais uniquement 3 plus un domaine fixé sur la face intracellulaire de la membrane (Wo et al. 1995). Les sites de liaison pour les agonistes se trouvent dans le domaine extracellulaire N-terminal et au niveau intracellulaire seraient placés 3 sites de phosphorylation par la protéine kinase A (Greengard et al. 1991, Raymond et al. 1993), un site pour la protéine kinase C (Tan et al. 1994), ainsi qu'un site pour la protéine kinase calcium-calmoduline-dépendante (CamKII) (Barria et al. 1997, Yakel et al. 1995), qui permettent également de moduler la fonction du récepteur.
Le récepteur NMDA
contient un canal perméable aux ions potassium, sodium et calcium et est responsable de la phase tardive du potentiel postsynaptique excitateur. Outre le site de liaison principal aux agonistes, ce récepteur contient également un site allostérique qui lie la glycine laquelle potentialise l'effet du glutamate (Forsythe et al. 1988). L'activation de ce site est nécessaire au fonctionnement du récepteur NMDA. A l'intérieur du canal, deux sites peuvent bloquer l'influx ionique : un site cationique voltage-dépendant, fixant l'ion magnésium et un site de liaison fixant des médicaments psychotropes ou des antagonistes non-compétitifs (TCP, PCP, MK801) (Wong et al. 1991). Il existe 5 sous-unités du récepteur NMDA. La sous-unité NMDA-R1, qui a 8 variants issus d'un épissage différentiel et ayant chacun une fonction différente et les sous-unités NMDA-R2a, b, c, d. Le récepteur NMDA serait pentamérique et doit contenir au moins une sous-unité NMDA-R1 pour être fonctionnel. Chaque sous-unité serait vraisemblablement constituée de 4 domaines transmembranaires, mais on envisage actuellement qu'elles puissent avoir la même configuration que les sous-unités du récepteur AMPA. Le domaine intracellulaire possède des sites de phosphorylation pour les protéines kinases C, CamKII et tyrosine kinase qui pourraient moduler l'excitabilité de ce récepteur (Bading et al. 1991, Moss et al. 1993, Kitamura et al. 1993, Wang et al. 1994).
Au repos, le récepteur NMDA participe peu à la transmission synaptique, le canal étant bloqué par la présence d'ions magnésium. Ce blocage est sensible au voltage et une dépolarisation membranaire permet d'enlever le bouchon magnésique et d'ouvrir le canal NMDA. Ce mécanisme, suivi de l'augmentation postsynaptique du calcium et l'activation conséquente de messagers secondaires, joue un rôle fondamental dans l'expression de divers mécanismes de développement (Kleckner et al. 1991), de neurotoxicité (Nadler et al. 1981, Rothman et al. 1987, Meldrum et al. 1990) ou encore de plasticité synaptique (Collingridge et al. 1987, Larson et al. 1988).
Dans le CA1 de l'hippocampe, il semble que les récepteurs AMPA ne soient exprimés que dans 75 % des synapses alors que les récepteurs NMDA le sont dans près de 100 % des synapses (Takumi et al. 1999). Dans une configuration où les deux types de récepteurs sont exprimés, seule une activation assez forte des récepteurs AMPA permet une dépolarisation suffisante pour supprimer le bloc magnésium des canaux NMDA. Toutefois, 25 % des synapses de l'hippocampe adulte n'expriment que des récepteurs NMDA. Bien qu'il semble que le bloc magnésique ne soit que partiel et donc qu'une proportion de canaux NMDA puissent être réactifs au glutamate, cette proportion est vraisemblablement trop faible pour permettre à la transmission synaptique de s'effectuer. De telles synapses sont alors considérées comme inactives ou silencieuses (Liao et al. 1995, Isaac et al. 1995). Il est apparu récemment que des synapses néoformées sont principalement de type silencieux et que la maturation de telles synapses implique l'expression des récepteurs AMPA (Petralia et al. 1999, Liao et al. 1999, Gomperts et al. 1998).
Récepteurs métabotropiques
Ce récepteur est formé de 7 domaines transmembranaires, d'un domaine intracellulaire et d'un domaine extracellulaire. Il existe au moins 8 récepteurs métabotropiques différents nommés mGluR1-8. Pour tous, la liaison du ligand provoque un changement de la conformation du récepteur et l'activation d'une protéine G. Les récepteurs mGluR1 et 5 sont couplés à une phospholipase-C, qui induit la transformation de phospholipides membranaires en phosphatidyl inositol triphosphate (IP3) et diacyl glycérol (DAG). L'augmentation de IP3 provoque la libération de calcium des stocks intracellulaires et donc une augmentation rapide de la concentration du calcium cytosolique, alors que la production du DAG entraîne l'activation de la protéine kinase C. Les 6 autres récepteurs sont bien moins connus, mais ils pourraient provoquer une réduction de la production de cAMP en activant une protéine G inhibitrice.
Le rôle des récepteurs métabotropiques est encore peu connu et dépendrait de leur localisation, présynaptique ou postsynaptique, et des protéines G auxquelles ils sont couplés. Les récepteurs présynaptiques servent d'autorécepteurs et pourraient participer à l'inhibition du relâchement de neurotransmetteur (Shigemoto et al. 1996). L'activation de certains récepteurs postsynaptiques induit une réduction des courants potassiques (Charpak et al. 1990) et une réduction des conductances calciques voltage-dépendantes. Le récepteur postsynaptique mGluR1 est impliqué dans la potentiation à long-terme dans l'hippocampe et la dépression à long-terme dans le cervelet (Aronica et al. 1990, McGuinness et al. 1991, Zheng et al. 1992, Bashir et al. 1993).
La plasticité synpatique
Ce n'est que récemment que les neurophysiologistes ont découvert les extraordinaires capacités de plasticité synaptique de l'hippocampe. En 1973, Bliss et ses collègues ont montré qu'une stimulation à haute fréquence de la voie perforante entraînait une augmentation persistante de l'efficacité de la transmission synaptique dans le gyrus denté (Bliss et al. 1973, Fig. 7A). Cette augmentation, qui peut durer plusieurs jours in vivo , a été appelée la potentiation à long-terme ou LTP. Elle a également été mise en évidence au niveau des connexions entre les collatérales de Schaffer et les épines dendritiques du CA1 (Andersen et al. 1977), ainsi que dans d'autres régions du système nerveux : les régions néocorticales et subcorticales et le système nerveux périphérique des mammifères (Pockett et al. 1993) ou de batraciens (Wan et al. 1999), la jonction neuro-musculaire des Arthropodes (Sigrist et al. 2000) , ainsi que des synapses d'organismes invertébrés (Bao et al 1998, Murphy et al. 1997).
Bien que les mécanismes impliqués dans l'expression de la LTP soient encore peu connus, elle montre différentes propriétés qui font d'elle un candidat particulièrement intéressant permettant d'expliquer les importantes capacités de stockage d'informations et d'apprentissage de l'hippocampe : premièrement, elle peut persister plusieurs jours, voire jusqu'à deux mois lorsqu'elle est induite artificiellement in vivo (Douglas et al. 1975). Deuxièmement, l'induction expérimentale de la LTP ressemble en beaucoup de points à l'activité synaptique observée in vivo : elle peut être induite par une stimulation de fréquence similaire à celle se déroulant naturellement dans l'hippocampe de rat lors de l'exploration spatiale, le rythme thêta, une onde de décharges brèves et synchrones de 5 à 7 Herz (Larson et al. 1988); dans l'amygdale, une structure responsable de l'apprentissage lié à la peur, la mémorisation produit une augmentation de l'efficacité de la transmission synaptique similaire à celle induite par la LTP (Rogan et al. 1997); une saturation de la LTP dans l'hippocampe interfère avec l'apprentissage spatial, renforçant l'idée que la LTP est requise pour un apprentissage normal (Moser et al. 1998) ; l'exploration spatiale d'un nouvel environnement peut annuler une potentiation induite auparavant (Xu et al. 1998) et enfin une stimulation visuelle répétitive peut provoquer une potentiation des synapses rétino-tectales (Zhang et al. 2000). Troisièmement, une modulation de la LTP induit une modification correspondante des capacités d'apprentissage. En effet, diverses études comportementales et pharmacologiques montrent qu'une inhibition de la LTP affecte différentes tâches de mémorisation faisant intervenir l'hippocampe chez le rat, telles que retrouver une plate-forme dans une piscine d'eau opaque, ou discriminer différentes odeurs (Morris et al. 1986, Staubli et al. 1989). De plus, de récentes manipulations génétiques ont permis d'augmenter l'expression de la LTP. Il s'en est presque toujours suivi une amélioration des performances des souris dans différentes tâches d'apprentissage (Manabe et al. 1998, Madani et al. 1999, Tang et al. 1999, mais voir aussi Migaud et al. 1998). Quatrièmement, la LTP est synapse-spécifique, ce qui implique que seules les synapses ayant reçu une stimulation à haute fréquence vont exprimer la LTP (Schuman et al. 1997). Cinquièmement, elle est coopérative, ce qui résulte de l'observation que la probabilité d'induire la LTP ou que l'ampleur de son expression augmente avec le nombre d'afférences stimulées. Cette dernière peut être changée en variant l'intensité de la stimulation extracellulaire : une stimulation de faible intensité ou de courte durée ne va que rarement induire la LTP, alors qu'une stimulation plus forte induit la LTP de manière plus fiable (McNaughton et al. 1978). Enfin, elle est associative, c'est à dire que l'induction de la LTP par la stimulation d'un petit groupe de fibres afférentes peut être facilitée par la stimulation simultanée d'un autre groupe d'afférences convergentes. Cette dernière propriété correspond au postulat de Hebb selon lequel une coïncidence d'activité entre deux neurones couplés synaptiquement pourrait provoquer une augmentation de l'efficacité de la transmission synaptique entre ces deux neurones. Une telle modification était, selon lui, la base cellulaire de l'apprentissage (Hebb 1949). En regard de ces différentes propriétés, la LTP dans l'hippocampe et plus particulièrement dans la région du CA1 est devenue le modèle physiologique des processus d'apprentissage le plus étudié de nos jours.
Alors que la LTP représente un mécanisme de stockage d'information, il est apparu plus récemment qu'un phénomène inverse, la dépression à long terme (LTD), pouvait jouer le rôle de mécanisme synaptique d'oubli (Dudek et al. 1992). Contrairement à la LTP qui est induite par une stimulation électrique à haute fréquence et dépend d'une forte entrée de Calcium dans l'épine dendritique à travers le canal NMDA et l'activation de protéine kinases, la LTD est induite par une stimulation à basse fréquence, dépend d'une entrée plus faible de calcium (Malenka et al. 1993) et fait intervenir des phosphatases (Mulkey et al. 1994) ainsi qu'une diminution du nombre de récepteurs AMPA à la surface de l'épine (Carroll et al. 1999). Son rôle dans l'apprentissage et les mécanismes responsables de la LTD ne sont toutefois pas encore aussi clairement élucidés que pour la LTP.



Mécanismes de la LTP
Une étape importante dans la compréhension des mécanismes d'induction de la LTP a été l'observation qu'elle pouvait être bloquée par des antagonistes spécifiques des récepteurs NMDA (Collingridge et al. 1983, Fig. 7B). Le rôle joué par ce récepteur dans l'induction de la LTP réside dans ses propriétés, à savoir que le canal ionique auquel il est lié est bloqué de manière « voltage-dépendante » par l'ion magnésium. Une ouverture du canal NMDA peut donc être effectuée si un ligand, le glutamate, se lie au récepteur en même temps que s'effectue une dépolarisation de la membrane postsynaptique. Ce récepteur a donc un rôle déterminant comme détecteur de coïncidence entre l'activité présynaptique et postsynaptique et cette propriété permet d'expliquer l'associativité de la LTP.
L'ouverture du canal NMDA entraîne l'entrée massive de calcium dans l'épine dendritique. L'augmentation de la concentration postsynaptique de cet ion, en forte concentration dans le milieu extracellulaire (2.5 mM), constitue une étape nécessaire et probablement suffisante pour l'induction de la LTP. En effet, des chélateurs du calcium, ainsi qu'une réduction de la concentration extracellulaire de cet ion empêchent l'induction de la LTP (Lynch et al. 1983). De plus, l'injection intracellulaire de calcium emprisonné par un chélateur photosensible a permis d'induire la LTP à l'aide d'un flash de lumière libérant le calcium (Malenka et al. 1988). Bien que ce mécanisme semble s'appliquer de manière relativement généralisée à l'induction de la LTP, de nombreuses synapses telles que celles formées par les fibres moussues et les cellules pyramidales de CA3 de l'hippocampe, peuvent induire la LTP d'une manière indépendante des récepteurs NMDA. En effet des canaux calciques « voltage-dépendants » présents dans de telles synapses permettent une entrée de Calcium suffisante pour induire la LTP (Harris et al. 1986, Morgan et al. 1999). De plus, il est récemment apparu que les récepteurs métabotropiques pouvaient également contribuer à l'induction de la LTP (Bashir et al. 1993). En effet, les récepteurs de type mGluR1 et mGluR5 sont couplés à une phospholipase C qui produit la formation de IP3, laquelle va induire, quoique plus lentement que le récepteur NMDA, une augmentation du calcium postsynaptique par libération des stocks intracellulaires. Cette hypothèse est toutefois controversée par des études plus récentes (Manzoni et al. 1994, Hsia et al. 1995).
Au vu de ces résultats et bien que différents récepteurs puissent être impliqués dans l'induction de la LTP, il semble que l'augmentation de calcium postsynaptique en soit l'élément primaire et indispensable.
Les processus biochimiques qui suivent cette phase d'induction sont encore relativement peu clairs. Le seul mécanisme actuellement connu est l'activation, par le calcium, d'une série de cascades enzymatiques. Il a en effet été observé que les épines dendritiques contiennent une très forte concentration de Calcium\calmoduline kinase II (CamKII), une protéine kinase activée par le calcium (Kennedy et al. 1983). Suite à l'induction de la LTP, cette enzyme est activée par l'entrée postsynaptique de calcium puis, par auto-phosphorylation, elle peut s'activer de manière constitutive, indépendamment du calcium (Miller et al. 1986) et rester active pendant plusieurs heures (Fukunaga et al. 1993, Barria et al. 1997). Il a ainsi été proposé que la CamKII pourrait participer à des modifications durables de l'efficacité synaptique en agissant comme une mémoire moléculaire (Lisman et al. 1988). Une des actions possibles de cette enzyme serait d'augmenter l'efficacité des canaux AMPA par phosphorylation de ces récepteurs (Barria et al. 1997) ainsi qu'en augmentant l'expression de ces protéines (Cammarota et al. 1998).
Un autre messager secondaire stimulé par le calcium est l'adénylate cyclase (Fig. 7B). Une fois activée, cette enzyme va induire la formation de cAMP qui, à son tour, actionne la protéine kinase dépendante du cAMP, la protéine kinase A (PKA). Outre l'autophosphorylation de la CamKII qu'elle favorise (Makhinson et al. 1999), la PKA serait également responsable de l'augmentation de la synthèse de certaines protéines telles que la CamKII (Wu et al. 1998) et le récepteur AMPA (Nayak et al. 1998, Shi et al. 1999) via son action sur le facteur de transcription CREB (Boshart et al. 1991, Ofir et al. 1991, Impey 1996). Cette synthèse de protéines apparaît environ 1 heure après l'induction de la LTP et est impliquée dans la consolidation de la LTP (Abel et al. 1997). Elle marque le début de la phase tardive de la LTP, la L-LTP par opposition à la phase précoce (E-LTP) qui dépendrait plutôt de modifications post-traductionnelles. Ainsi, il a été proposé que des enzymes telles que la CamKII soient responsables de l'initiation de la LTP, puis que le relais soit ensuite pris par la synthèse de récepteurs. En accord avec cette hypothèse, il a été observé que des inhibiteurs de la CamKII inhibent l'induction même de la LTP, sans pour autant affecter à posteriori une LTP déjà induite (Malinow et al. 1989). Des inhibiteurs de la PKA ou de la synthèse de protéines vont, par contre, permettre à la LTP de s'exprimer pendant environ 1 à 3 heures seulement, avant de provoquer un fléchissement de la potentiation (Nguyen et al. 1996).
Une autre hypothèse permettant d'expliquer l'augmentation de l'efficacité synaptique est l'activation de synapses silencieuses. Comme décrit plus haut, environ 25% des synapses hippocampales adultes n'expriment que le récepteur NMDA (Takumi et al. et al. 1999) et sont inactives - ou silencieuses - au potentiel de repos. Cette proportion est plus élevée dans un cerveau immature et il semblerait que le développement puisse, par augmentation de l'expression des récepteurs AMPA, rendre actives des synapses silencieuses (Liao et al. 1999, Petralia et al. 1999). Différentes études suggèrent qu'un tel mécanisme puisse être également impliqué dans l'expression de la LTP (Isaac et al. 1995, Liao et al. 1995, Lissin et al. 1998, 1999, Shi et al. 1999).
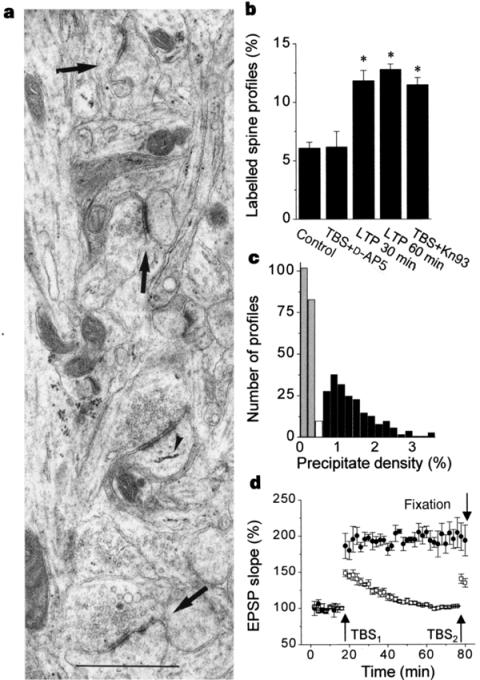
De tels effets sur les récepteurs AMPA pourraient à eux seuls suffire pour provoquer la potentiation synaptique qui caractérise la LTP. Cette hypothèse est renforcée par l'observation que l'augmentation de l'efficacité des récepteurs AMPA est occultée par une induction préalable de la LTP. Toutefois, compte tenu du recyclage relativement rapide des protéines, comment expliquer le maintien à long terme de la LTP ? Comment expliquer que des éléments biochimiques dont la durée de vie est de quelques jours voire de heures seulement permettent le maintien d'une information pendant plusieurs semaines ? Une possibilité, évoquée par Ramòn y Cajal déjà, est que l'activité synaptique modifie la structure des synapses et que ces modifications influencent en retour la fonction synaptique. Quoique souvent contestées, de nombreuses études, décrites plus en détail au chapitre consacré aux épines dendritiques, ont en effet pu mettre en évidence qu'une modification de la structure de l'épine est associée à l'expression de la LTP. Outre ces différents types de modifications de la morphologie postsynaptique, quelques études se sont intéressées également à la morphologie de la structure présynaptique. Suivant l'hypothèse de Bliss (Bliss et al. 1986) selon laquelle la LTP pourrait être due à une augmentation de la libération de neurotransmetteurs, plusieurs groupes ont analysé le nombre ainsi que la répartition des vésicules présynaptiques suite à l'induction de la LTP. Toutefois, ces études ont abouti à des résultats contradictoires et n'ont pas permis d'étayer l'hypothèse de Bliss (Fifkova et al. 1977, Chang et al. 1984, Applegate et al. 1987). La LTP pourrait également induire des modifications de l'arborisation dendritique (Ivanco et al. 2000). Enfin, des modifications de la morphologie de cellules non-neuronales ont pu être mises en évidence. Suite à l'induction de la LTP, le groupe de Wenzel a en effet pu observer une augmentation de la surface de contact que forment les processus astrocytaires avec les synapses (Wenzel et al. 1991). Le rôle exact de cette augmentation est encore peu connu et il reste à déterminer si elle est spécifique aux synapses activées ou s'il s'agit d'une réaction générale des cellules gliales à la stimulation. Toutefois, des études récentes semblent indiquer que les cellules gliales puissent jouer un rôle dans la transmission synaptique et notamment en contrôlant la concentration en neurotransmetteurs dans la fente synaptique. (Clements et al. 1992, Harris et al. 1999, Diamond et al. 2000).
Des modifications de la structure du neurone ont pu être observées parfois longtemps encore après l'induction de la LTP, ce qui pourrait permettre d'expliquer le maintien à long terme de l'augmentation de l'efficacité synaptique. De plus, cette hypothèse est renforcée par l'observation que différentes protéines morphorégulatrices sont également impliquées dans l'expression de la LTP. Par exemple, des manipulations génétiques ont récemment pu montrer que l'activateur tissulaire de plasminogène (tPA), une protéase extracellulaire dont l'expression est régulée par l'activité synaptique (Qian et al. 1993), joue un rôle important dans l'expression de la LTP (Madani et al. 1999). Cette enzyme pourrait notamment agir au niveau de la matrice extracellulaire en fragilisant les adhésions cellulaires, permettant ainsi à une restructuration morphologique de s'effectuer. Une autre protéase, la calpaïne, est activée par l'augmentation de calcium intracellulaire consécutive à l'induction de la LTP (Vanderklish et al. 1995). Cette protéase intracellulaire digère la spectrine, une protéine du cytosquelette qui contribue à la distribution des récepteurs (Dmytrenko et al. 1993) et à l'organisation des lipides membranaires (Goodman et al. 1986). En fragilisant ainsi la structure de l'épine, elle pourrait favoriser ses modifications. En effet, une inhibition de la calpaïne bloque l'expression de la LTP (del Cerro et al. 1990, Denny et al. 1990). Les molécules d'adhésion jouent également un rôle dans l'expression de la LTP. En effet, différentes molécules interférant avec la liaison de la molécule d'adhésion NCAM (Lüthi et al. 1994, Muller et al. 1996) ou avec les intégrines (Staubli et al. 1998) empêchent l'induction de la LTP. Comme pour les protéases extracellulaires, il est suggéré qu'une diminution de l'efficacité des molécules d'adhésion permette aux restructurations membranaires de s'effectuer et à la plasticité morphologique de s'exprimer.
Bien que ces résultats indiquent que le site d'expression de la LTP soit essentiellement postsynaptique, différentes observations suggèrent que la LTP puisse également avoir des répercussions au niveau présynaptique. L'une d'entre elles implique l'oxyde nitreux (NO) comme messager rétrograde circulant de l'épine dendritique vers le terminal présynaptique par le milieu extracellulaire. En faveur de cette hypothèse, une inhibition pharmacologique ou génétique de l'expression d'une forme de l'enzyme de synthèse du NO, la eNOS, inhibe l'expression de la LTP (Kantor et al. 1996). Il a été suggéré que le NO puisse agir présynaptiquement en augmentant la libération de neurotransmetteur. Bien qu'une augmentation de la libération du glutamate après induction de la LTP ait été effectivement observée (Bliss et al. 1986), ces résultats ainsi que l'effet du bloc de la NO synthase sur la LTP sont encore largement controversés (Aniksztejn et al. 1989).
La synapse
« Les neurones, ces papillons mystérieux de l'âme,
dont les battements d'ailes pourraient - qui sait -
clarifier un jour le secret de la vie mentale. »
Ramòn y Cajal
C'est vers 1888 que Ramòn y Cajal établit que les contacts entre les terminaisons axonales d'un neurone et les dendrites ou le soma d'un autre neurone sont les sites de transmission de l'influx nerveux. En 1897, Sherrington proposa le terme de synapse (du grec sunapsis : point de jonction) pour désigner ces zones de contact entre neurones, spécialisées dans la transmission d'informations. En fait le terme synapse désigne également les connexions entre neurones et cellules effectrices (cellules musculaires et glandulaires) ou encore entre cellules réceptrices et neurones.
Selon des critères morphologiques et fonctionnels, on distingue plusieurs types de synapses :
- Les synapses chimiques, caractérisées par la présence d'un espace de 10 à 20 nm. entre les membranes plasmiques des cellules connectées, appelé fente synaptique. Un neurotransmetteur, contenu dans des vésicules présynaptiques, est alors relâché dans la fente synaptique pour transmettre les informations aux récepteurs contenus dans la densité post-synaptique. Bien souvent, les synapses sont axo-dendritiques, mais elles peuvent également être axo-somatiques, axo-axonales, dendro-dendritiques, somato-somatiques, somato-dendritiques ou encore dendro-somatiques (Peters et al. 1991). De plus, il existe des types très variés de synapses chimiques telles que les synapses réciproques, formées de deux synapses chimiques orientées en sens inverse l'une de l'autre, ou encore les glomérules, formés par un ensemble de synapses chimiques : un axone peut se trouver entouré d'un ensemble de dendrites avec lesquelles il est en contact synaptique et de même, une dendrite peut recevoir les informations de plusieurs axones au même endroit. On distingue enfin les synapses de type I, principalement excitatrices et les synapses de type II, plutôt inhibitrices (Gray et al. 1969). Ces dernières sont dites symétriques, parce qu'elles présentent une zone électron-dense de chaque côté de la jonction. Les vésicule synaptiques sont plutôt ovales, la fente synaptique relativement petite (12 nm.) et la densité postsynaptique (PSD) est peu marquée. Elles représentent environ 16 % des synapses du cortex. Les synapses de type I sont asymétriques, c'est à dire que la membrane présynaptique ne comporte pas de matériel électron-dense. La PSD est bien marquée, les vésicules synaptiques sont rondes et la fente synaptique légèrement plus grande : 20 nm. Le type I représente 84% des synapses du cortex.
- Les synapses électriques ou « gap junctions » qui se caractérisent par l'accolement des membranes pré et post-synaptiques à travers lesquelles le signal électrique passe directement d'une cellule à l'autre, sans intermédiaire chimique. Puisqu'il n'y a pas de neurotransmetteur impliqué dans le fonctionnement d'une telle synapse, la transmission du signal est plus rapide que pour la synapse chimique. Bien que plus fréquentes chez les vertébrés inférieurs et les invertébrés que chez les mammifères, de telles synapses ont été récemment décrites dans l'hippocampe de rat entre les interneurones inhibiteurs, où elles pourraient être impliquées dans la synchronisation de l'activité électrique (Tamas et al. 2000).
- Les synapses mixtes, formées par la juxtaposition d'une synapse chimique et d'une synapse électrique. Chez les mammifères, ces synapses sont plus fréquentes que les synapses électriques.
Les épines dendritiques
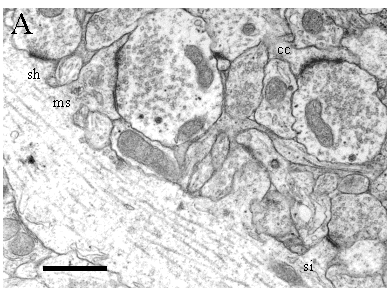
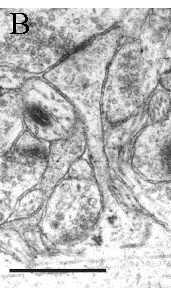
Dans l'hippocampe, la grande majorité de la transmission excitatrice s'effectue à travers des synapses chimiques, glutamatergiques, entre axones et épines dendritiques, alors que les fibres provenant des interneurones inhibiteurs se terminent directement sur les dendrites des cellules pyramidales (synapse de type shaft) ou sur le corps cellulaire. L'élément présynaptique, le terminal axonal, peut soit se trouver au bout d'une ramification de l'axone et s'appelle bouton terminal, soit former une varicosité le long de l'axone non-myélinisé ou dans les noeuds de Ranvier des axones myélinisés et s'appeler bouton en passant. L'élément postsynaptique, l'épine, est une excroissance dendritique terminée par un renflement, qui donne cette apparence de rosier épineux aux dendrites observées en microscopie optique (Fig. 3). Une cellule pyramidale adulte reçoit environ entre 15000 et 25000 contacts synaptiques, dont environ 80 à 90 % se font sur des épines dendritiques. Etant donné qu'un neurone du CA3 contacte une cellule du CA1 par environ 3 à 7 synapses, on peut évaluer qu'un seul neurone du CA1 est en contact avec environ 5000 neurones du CA3 (Wenzel et al. 1973, Amaral et al. 1990, Andersen et al. 1990, Bannister et al. 1995).
Structure fine
Décrites tout d'abord par Ramòn y Cajal en microscopie optique (1888) puis par Gray (1959) et Westrum (1966) en microscopie électronique, les épines dendritiques sont constituées d'un cou formant l'attache à la dendrite et d'une tête, renflement contenant la densité postsynaptique (PSD) et au bout duquel s'établit généralement la connexion synaptique. Chez le rat adulte, les épines dendritiques du CA1 hippocampal mesurent de 0.2 à 2.5 mm de longueur pour un diamètre de 0.04 à 0.5 mm au niveau du cou. La tête a un volume de 0.003 à 0.55 mm3 et la PSD recouvre une surface de 0.008 à 0.54 mm2 (Harris et al. 1992, Fiala et al. 1999, http://synapses.bu.edu/), soit 10 à 15 % de la membrane de la tête.
Contrairement au bouton axonal et aux énormes épines branchées du CA3 (Chicurel et al. 1992), l'épine dendritique du CA1 ne contient pas de mitochondries, ni de cytosquelette suffisamment dense pour être observé en microscopie électronique (tel que les microtubules ou neurofilaments facilement observables dans les dendrites ou les axones). Par contre, la microscopie électronique révèle la présence d'une quantité de structures définissables morphologiquement et ayant une fonction locale bien précise (Fig. 8).


Ainsi on observe l'appareil de l'épine, qui est une prolongation du réticulum endoplasmique lisse issu de la dendrite, ainsi que des ribosomes, libres ou associés à l'appareil de l'épine. L'appareil de l'épine se trouve principalement dans les épines de grande dimension et apparaît associé au spinule, sorte d'excroissance de la membrane postsynaptique, dépourvue de PSD (Tarrant et al. 1979, Harris et al. 1989, Sorra et al. 1998). Outre la synthèse locale de protéines (Pierce et al. 2000), l'appareil de l'épine pourrait également jouer un rôle dans la régulation du calcium (Burgoyne et al. 1983, Fifkova et al. 1983) et participer, avec les vésicules d'endo\exocytose coatées, à la régulation de la membrane postsynaptique (Muller et al., sous presse). Dernier élément de l'épine visible en microscopie électronique, la densité postsynaptique (PSD), contient non seulement les récepteurs au glutamate, mais également plus de 30 constituants différents tels que des protéines du cytosquelette, des enzymes de glycolyse, des messagers secondaires, des «heatshock proteins », des protéines de transport vésiculaire, etc... Située en face de la zone active présynaptique, elle sert d'organisateur général de la machinerie de transduction du signal postsynaptique, qui lie des molécules régulatrices à leurs cibles, coordonne les changements développementaux et liés à l'activité synaptique et établit la topographie fonctionnelle de la membrane postsynaptique.
Composants moléculaires
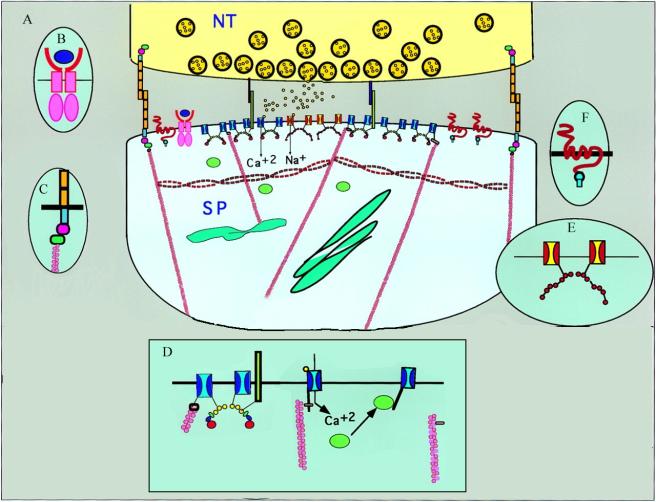
Tout d'abord, la fente synaptique. Cet espace de diffusion des neurotransmetteurs contient une série de protéines de la matrice extracellulaire et des molécules d'adhésion, telles que Densin 180, Cadhérines, neuroligans, neurexines. Ces molécules joueraient un rôle dans l'alignement des membranes pré et post-synaptiques et le maintien de leur structure. De plus, certaines d'entre elles, telle que les cadhérines, possèdent un domaine intracellulaire avec lequel elles forment des liaisons avec des protéines cytosquelettiques, telles que la b-Caténine, liée elle-même à l'actine, formant ainsi une continuité entre le cytosquelette de l'épine et le milieu extracellulaire (Aberle et al. 1996).
C'est dans les épines que se trouve la plus grande concentration de filaments d'actine (Fifkova et al. 1982, Fischer et al. 1998). Cet élément du cytosquelette sert non seulement à maintenir la structure de l'épine, mais également à limiter la mobilité des récepteurs en les ancrant à d'autres microfilaments tels que la spectrine, ainsi qu'à lier l'appareil de l'épine à la PSD. L'actine montre une grande activité de polymérisation, sous le contrôle négatif du calcium cytosolique libre. Une variation de la concentration de calcium dans l'épine, induite par l'activité synaptique, peut moduler les interconnections entre la PSD et différentes organelles, ainsi que provoquer des changements rapides et radicaux de la structure de l'épine (Fischer et al. 1998). De plus, la faible diffusion du calcium dans le cytoplasme suggère que des changements de la concentration de cet ion pourraient être très localisés (Cline et al. 1991) et permettre des modifications circonscrites de la structure du cytosquelette. Notons également d'autres éléments du cytosquelette tels que a-actinine-2, qui peut lier les récepteurs NMDA de manière dépendante de la calcium/calmoduline (Wyszynski et al. 1997), la myosine-B, un moteur moléculaire qui pourrait être impliqué dans le trafic des protéines entre la PSD et le cytoplasme (Husi et al. 2000), ou encore MAP2, fodrine, dystrophine, drebrine, amyloid precursor protein 1 et a-adducine, dont les rôles ne sont pas encore élucidés.
Un composant majeur de la PSD est une protéine kinase, la Calcium/Calmoduline kinase II (CamKII) (Kennedy et al. 1983) qui joue un rôle central dans l'expression de la LTP et de la plasticité synaptique (Lisman et al. 1994). Une autre protéine kinase, la Fyn tyrosine kinase, peut phosphoryler les sous-unités NR2A et B du récepteur NMDA et ainsi augmenter son activité (Suzuki et al. 1995). Il existe également d'autres protéines régulatrices telles que la protéine kinase C, ERK2-type mitogen-activated protein kinase, protéine phosphatase 1 et protéines G. La calpaïne, une protéase régulée par le calcium, peut interférer avec le lien entre récepteurs et cytosquelette. Elle peut cliver des sous-unités du récepteur AMPA (Bi et al. 1994), des canaux calciques, ainsi que dégrader la spectrine (Dosemeci et al. 1995) et permettrait ainsi une réorganisation des récepteurs AMPA. Cette molécule est également impliquée dans l'expression de la LTP (Vanderklish et al. 1995).
L'épine dendritique montre non seulement une polarisation bien marquée mais de plus, de nombreuses molécules y sont positionnées très précisément selon leur rôle ou leur cible spécifique. Certaines des protéines régulatrices citées plus haut seraient positionnées par des protéines adaptatrices telles que AKAP79, AKAP150 (Carr et al. 1992). Les récepteurs au glutamate sont également maintenus à une position précise et regroupés en face des vésicules présynaptiques. De plus, les récepteurs AMPA se trouvent au milieu de la PSD, alors que les récepteurs métabotropiques se trouvent plutôt à la périphérie (Nusser et al. 1994). Un tel rôle de positionnement des récepteurs serait tenu par des protéines telles que PSD95 (Nieto-Sampedro et al. 1982), PSD93, SAP102, SAP97, GRIP, ABP. Ces protéines contiennent toutes un même motif, le domaine PDZ (Kennedy et al. 1995), qui se retrouve également dans les jonctions serrées et servirait à lier les récepteurs aux protéines cytoplasmiques. Certaines de ces protéines sont appelées MAGUK (membrane-associated guanylate kinase) car elles contiennent un domaine de type guanylate kinase, bien qu'elles n'aient pas d'activité enzymatique (Anderson et al. 1996).
D'autres récepteurs se trouvent également dans la PSD, tels que TrkB, le récepteur au BDNF (brain-derived neurotrophic factor) (Wu et al. et al. 1996), qui peut stimuler la phosphorylation de la sous-unité NR1 du récepteur NMDA et ainsi moduler son activité (Suen et al. 1997).
Une étude biochimique récente (Husi et al. 2000) a mis en évidence que les récepteurs NMDA font partie d'un complexe protéinique, le NRC (NMDA receptor-associated protein complex) contenant une centaine de protéines différentes, dont certaines ont été identifiées à des protéines du cytosquelette, des récepteurs, des adaptateurs, des messagers secondaires tels que décrits plus haut. Cette découverte indique que l'organisation de la PSD est hautement complexe et permettrait un positionnement très précis des récepteurs et des machineries de transduction aux sites de contact pré et postsynaptiques. Ainsi, bien qu'en microscopie électronique l'épine dendritique semble dénuée de structures cytosquelettiques et d'organelles, elle contient une grande proportion de molécules nécessaires tant pour le maintien de la structure et de la fonction synaptique, que pour leur modulation. Ces molécules pourraient être impliquées dans différents processus biochimiques associés à l'activité synaptique et la LTP.

Différents types d'épines
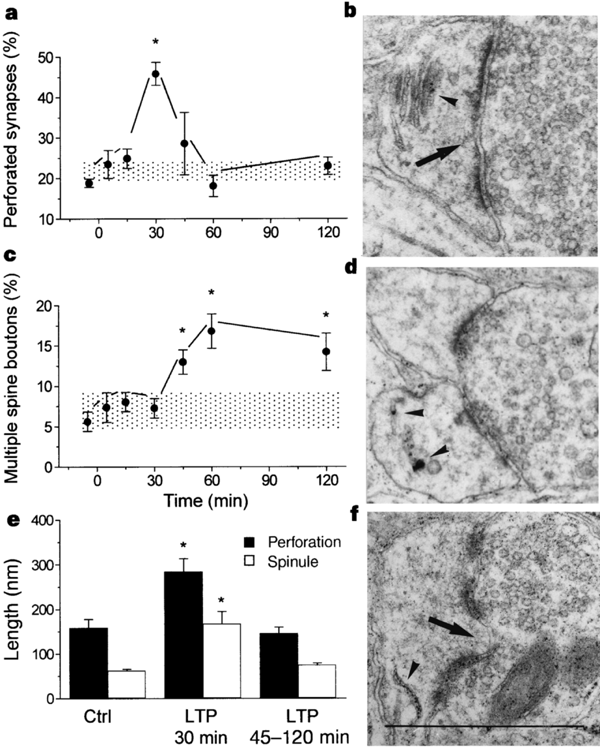
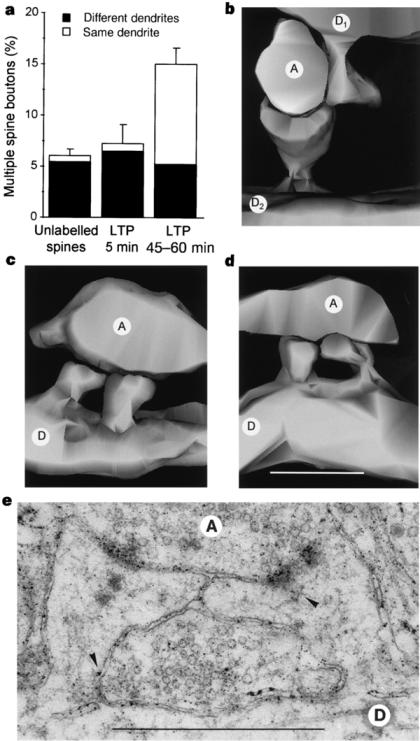
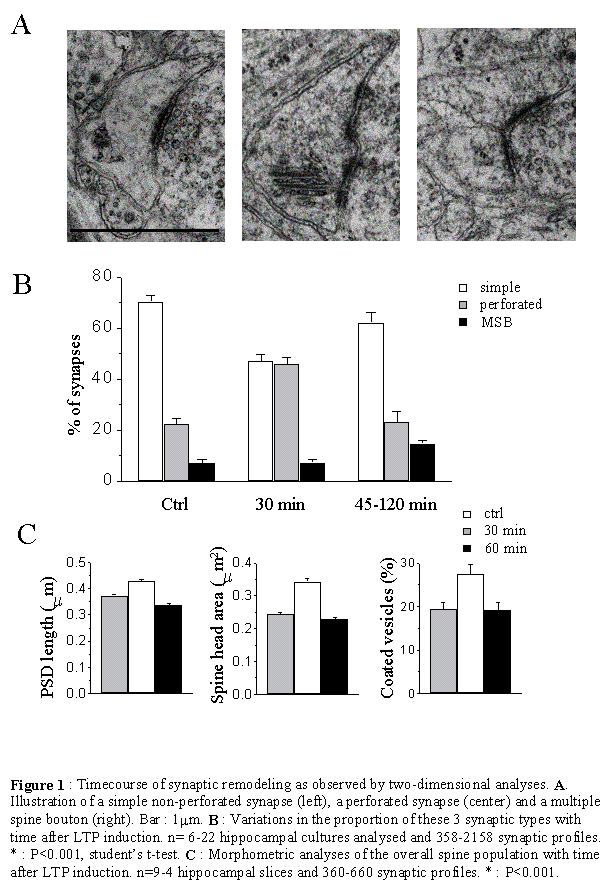
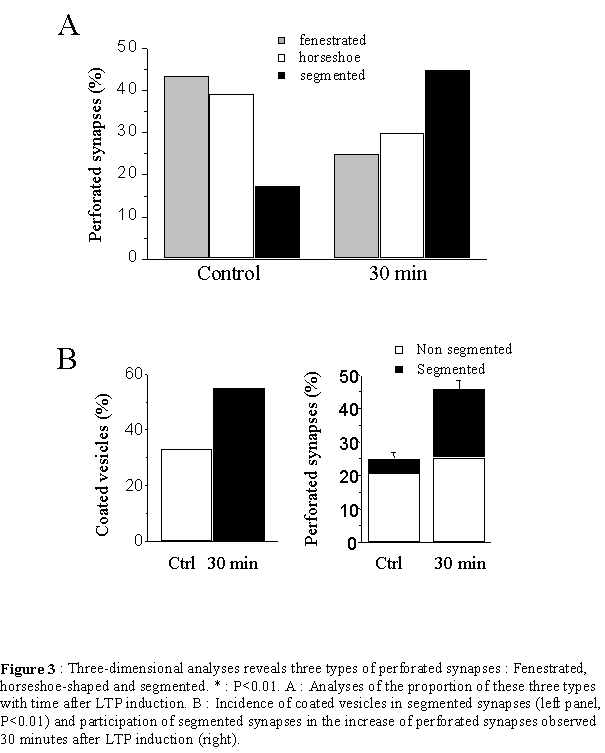
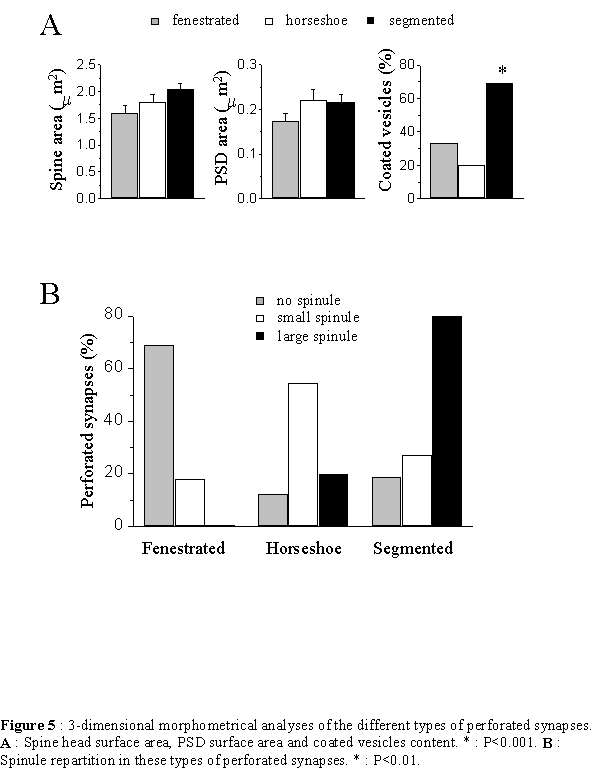
Il existe une grande diversité morphologique des épines et une classification exacte des types morphologiques est forcément incomplète compte tenu des différentes formes intermédiaires qui peuvent exister. Un des premiers critères de classification consiste à séparer les épines en fonction des caractéristiques de la PSD (Fig. 10). Celle-ci peut s'incurver vers l'intérieur de l'épine, ce sont les épines concaves ou négatives ou encore en sourire, ou s'incurver vers l'intérieur du bouton présynaptique dans le cas des synapses convexes ou positives (Jones et al. 1978). La PSD peut encore présenter des discontinuités, c'est à dire des zones membranaires non électron-denses, probablement dépourvues de récepteurs. Ce sont les épines perforées décrites par Peters en 1969. On distingue trois types de PSD perforées reconnaissables uniquement selon une analyse tridimensionnelle (Cohen et al. 1978, Geinisman et al. 1987). Les PSD fenestrées présentent, vu depuis le boutons axonal, un cercle électron-dense au centre duquel se trouve une tache plus claire. Les PSD en fer a cheval forment un U et les PSD segmentées présentent deux zones électron-denses distinctes. Une autre manière de classifier les épines est basée sur la forme du cou et de la tête de l'épine (Jones et al. 1969, Peters et al. 1970, Fig. 10). Ainsi, de grandes épines avec un cou large et court et une grosse tête sont appelées « mushroom-shaped spines». Des épines de dimensions plus restreintes avec un cou court, sont appelées « stubby spines » et des épines avec un long cou mince, « thiny spines ». Enfin, les épines branchées sont des épines siamoises, où deux ou plusieurs têtes émergent du même cou (Hamlyn et al. 1962, Harris et al. 1988, 1989). Contrairement au CA3 (Chicurel et al. 1992), il semble que dans le CA1, ces épines ne contactent jamais le même bouton axonal (Sorra et al. 1998), réfutant l'hypothèse selon laquelle elles pourraient représenter un stade intermédiaire de synaptogenèse par division d'une épine simple en deux (Nieto-Sampedro et al. 1982, Carlin et al. 1983). Un autre type de synapses, par contre, semble être révélateur d'une synaptogenèse : les synapses à épines multiples ou MSB, de l'anglais : « multiple spine boutons ». Il semble en effet que la plupart des épines néoformées chez l'adulte se connectent à un bouton synaptique qui a déjà une synapse, formant ainsi une structure où un bouton contacte plusieurs épines (Friedlander et al. 1991, Woolley et al. 1996, Kirov et al. 1999). Enfin, si le bouton axonal établit un contact avec un élément postsynaptique qui ne présente pas de tête ou ni cou ni tête, on ne parle alors plus d'épine, mais de synapse de type sessile et shaft respectivement. Notons également la présence de longs prolongements dendritiques dépourvus de tête, les filopodes, au bout ou le long desquels se trouvent parfois une synapse. Ces structures sont caractéristiques d'un tissu immature et pourraient représenter une étape précoce de la formation d'une épine dendritique et donc de la synaptogenèse (Fiala et al. 1998).
Les épines dendritiques ont une structure très hétérogène. Au sein d'un même segment dendritique d'une seule cellule pyramidale du CA1 de l'hippocampe, il y a une grande diversité de la morphologie des épines comme il a été montré par des reconstructions tridimensionnelles (Fig. 9H, Harris et al. 1989). Cette hétérogénéité pourrait refléter l'individualité de chacune d'entre-elles et être une conséquence de leur historique.







Rôle des épines et de leur diversité
L'épine dendritique, par sa forme, constitue un microcompartiment relativement isolé de la dendrite, permettant de conserver l'individualité des « inputs » synaptiques et lui permettant de fonctionner comme une unité intégrative multifonctionnelle (Shepherd et al. 1996). Elle contient plusieurs éléments régulateurs lui permettant d'effectuer des processus biochimiques spécifiques, indépendamment du reste de l'arborisation dendritique. En diminuant la diffusion de différentes molécules telles que le calcium (Muller et al. 1991, Yuste et al. 2000), elle évite une propagation non spécifique de la potentiation, permettant ainsi un maintien de la spécificité de la LTP (Bliss et al. 1973). Sa structure ainsi que sa fonction peuvent être modulées selon l'activité synaptique locale, lui donnant ainsi une position clé dans l'expression de mécanismes de plasticité synaptique.
La diversité morphologique des épines pourrait représenter les différentes étapes à travers lesquelles une épine individuelle doit passer avant d'atteindre un état mature ainsi que les différents états dynamiques dépendant de l'historique de vie des épines individuelles et de leur fonction. Elle pourrait également refléter la diversité de fonction des différentes synapses du cortex (Walmsley et al. 1988). En effet, plusieurs études de modélisation indiquent que la forme et le nombre des épines, ainsi que la répartition des récepteurs ou encore de diverses organelles, pourraient influencer l'efficacité de la transmission synaptique :
Une constriction du cou de l'épine ou une modification de l'organisation de ses organelles peut engendrer une barrière résistive qui, selon la loi d'Ohm, résulte en une amplification de la dépolarisation dans la proximité immédiate de la synapse (Brown et al. 1988, Pongracz, et al. 1985). Le bouchon magnésique du canal NMDA pourrait ainsi être plus facilement débloqué et la conductance de ce dernier améliorée.
La quantité de glutamate se trouvant dans la fente synaptique à la suite du relâchement par un simple quanta vésiculaire pourrait partiellement dépendre de la forme de la fente synaptique, mais aussi de la présence de processus gliaux contenant des systèmes de recaptage (Clements et al. 1992).
La probabilité de libération vésiculaire de neurotransmetteur suivant l'arrivée d'une impulsion nerveuse est très variable entre fibres présynaptiques et même entre sites de libération au sein de la même fibre. Elle peut être influencée par le nombre total de vésicules apposées et donc par l'aire du site de libération ainsi que par le nombre de ces sites (Atwood et al. 1983, Rosenmund et al. 1993, Hessler et al. 1993). La perforation de la PSD pourrait également provoquer une augmentation du nombre de sites de libération. De plus, il a été proposé que la zone active se trouvait en bordure de la PSD (Kaiserman et al. 1969). Ainsi, une perforation de la PSD pourrait augmenter la quantité de zone active donc l'efficacité de la transmission synaptique.
Ainsi, il semble que non seulement la forme de la synapse et principalement de l'épine dendritique puisse se modifier selon son état fonctionnel, mais également qu'une variation de la morphologie de l'épine puisse induire une modification de sa fonction. Cette interdépendance entre la structure et la fonction de la synapse a engendré de nombreuses études anatomo-fonctionnelles, dont nous allons faire ici un bref exposé.
Modifications de la structure des épines dendritiques (revue de Horner, 1993)
Ramon y Cajal, toujours lui, nota dans ses premières observations en 1911, que certaines drogues telles que des agents soporifiques ont un effet sur la morphologie des épines. Il est apparu ensuite que les épines dendritiques semblent sensibles à une multitude de phénomènes naturels ainsi qu'à des conditions expérimentales. En effet, des paramètres aussi différents que le développement et la vieillesse, le genre et l'état hormonal, l'hibernation et les changements de température, l'alcoolisme, l'épilepsie, la maladie d'Alzheimer, certains retards mentaux, des maladies génétiques, la malnutrition et la déshydratation, l'hypoxie, l'expérience, la complexité de l'environnement et enfin l'apprentissage et l'expression de la LTP peuvent modifier la structure ou le nombre de synapses et d'épines dendritiques de différents types neuronaux.
Modifications liées au développement et à l'âge
Une première cause de la variation de la morphologie des épines dendritiques est le développement. Chez les différents mammifères étudiés tels que la souris, le rat, le lapin, le chat, le singe et l'homme, il apparaît que le nombre de synapses augmente lors du développement pour atteindre une valeur maximale peu après la naissance. Ensuite, environ la moitié des synapses dégénère pour atteindre un niveau stable jusqu'à l'âge adulte. Cette élimination de synapses dépend de l'activité synaptique durant une période critique du développement et est nécessaire à l'affinement du réseau synaptique (Kakizawa et al. 2000). Dans le CA1 de l'hippocampe de rat, par exemple, la densité d'épines passe de 0.02 à 0.55 par micromètre de dendrite entre 21 jours de gestation et 20 jours après la naissance (Minkwitz et al. 1975). Dans le cortex visuel de l'être humain, la densité d'épines par micromètre de dendrite passe de 0.6 chez un foetus de 8 mois à 1 chez le nouveau-né, puis 1.6 à 5 mois, pour retourner à 1 chez l'enfant de 2 ans et l'adulte (Michel et al. 1984). Non seulement leur densité varie, mais il semble également que la forme des épines évolue avec le temps. En effet, on observe avec l'âge une augmentation de la proportion d'épines de type branchées, « thiny » et « mushroom » perforées et une diminution des épines de type « stubby », c'est à dire plus courtes et trapues. Cette évolution se fait parallèlement à l'apparition de l'excitabilité neuronale et joue certainement un rôle important dans la maturation du cerveau, notamment dans sa capacité à exprimer différentes formes de plasticité synaptique (Harris et al. 1992).
Enfin, alors que la densité d'épines reste stable tout au long de la vie de l'adulte, elle diminue chez les individus âgés, ce qui est en relation directe avec la fonction des zones corticales concernées. Dans le cortex pyramidal de rat, il a été observé une diminution de 24 % à 40 % selon les segments dendritiques observés, entre le troisième mois et la troisième année de vie. Cette perte d'épines due à l'âge est aussi sévère que la perte induite par une déprivation sensorielle (Feldman et al. 1975). Dans le CA1 de l'hippocampe, bien que cette diminution semble plus restreinte puisque 10 à 12 % seulement des épines disparaissent (Nunzi et al. 1989), elle est également accompagnée par une diminution du nombre d'épines perforées ainsi que par un affaiblissement de la fonction et des performances de la mémoire spatiale (Geinisman et al. 1986). Une réduction de l'arborisation des dendrites a également été observée avec le vieillissement (Schierhorn et al. 1981). Il est intéressant de noter enfin que cette perte n'affecte pas un type particulier d'épine, mais s'effectue sur le neurone entier bien que tous les neurones ne soient pas affectés de la même manière.
Modifications liées à l'état hormonal
Il semble que le genre ainsi que l'environnement hormonal puisse également jouer un rôle sur l'organisation et le branchement des dendrites ainsi que sur la densité des épines.
Dans le CA3 de l'hippocampe de rat, les femelles ont plus de dendrites primaires et les mâles ont plus d'épines sur les dendrites apicales (Gould et al. 1990), un effet qui pourrait être dû aux différences hormonales. De plus, dans le CA1 hippocampal de rat, la densité d'épines fluctue de manière naturelle en fonction des variations cycliques d'oestrogène et de progestérone (Woolley et al. 1990). Durant le pro oestrus, quand ces hormones sont les plus concentrées dans le sang, la densité d'épines est aussi à son niveau le plus élevé. Elle peut ensuite chuter de 30% en près de 24 heures entre le pro oestrus et l'oestrus, quand le taux hormonal retombe. Cet effet est très certainement lié aux variations hormonales, puisqu'il disparaît lorsque l'animal a subi une ovariectomie et réapparaît lors d'un traitement de remplacement aux oestrogènes (Gould et al. 1990). Comme dans d'autres cas de synaptogenèse dans le cerveau adulte, les épines qui sont créées suite à l'augmentation en oestrogènes se forment essentiellement avec des axones qui contactent déjà une épine dendritique, ce qui donne lieu à des boutons à épines multiples (Woolley et al. 1996).
Cette sensibilité aux hormones sexuelles est spécifique au CA1 de l'hippocampe et à l'hypothalamus, mais ne se retrouvent pas dans d'autres régions telles que le CA3 ou le gyrus denté. Elle pourrait être due à la présence dans le CA1 de récepteurs à la progestérone et de l'accumulation d'oestrogènes (Parsons et al. 1982).
En plus de modifier la densité des épines, les hormones sexuelles induisent une variation de l'excitabilité des neurones du CA1 (Teyler et al. 1980) ainsi que de leur plasticité synaptique (Warren et al. 1995). Différentes études relatent également un effet des oestrogènes sur les performances de mémorisation spatiale chez le rat (Simpkins et al. 1997), ainsi que spatiales et verbales chez l'Humain (Hampson et al. 1990, Berman et al. 1997). Bien que le rôle d'une telle activité des hormones sexuelles reste encore mystérieux, il a été proposé qu'elles puissent préparer le comportement maternel (Woolley et al. 1998).
Une autre hormone qui influence la formation des épines dendritiques est l'hormone thyroïdienne. Hauser (Hauser et al. 1984) a observé qu'un traitement des têtards du crapaud boeuf avec cette hormone accélérait de 2 ans la maturation des synapses du cervelet entre les cellules de Purkinje et les fibres grimpantes. Au contraire, l'hypothyroïdisme conduit à une diminution du nombre d'épines ainsi que de leur état de maturation (Mussa et al. 1989). Contrairement aux batraciens, le cerveau de rat montre une faible réaction à l'hyperthyroïdisme, qui se traduit toutefois par une diminution du nombre d'épines dendritiques localisées dans les dendrites apicales des cellules du CA1 (Gould et al. 1990).
Le stress, via une augmentation de la production de glucocorticoïdes, semble également influencer le nombre de synapses dans l'hippocampe. En effet, l'exposition d'un rat à un stress psychosocial provoque, dans le CA3, une augmentation du nombre de synapses (Sunanda et al. 1995) et une diminution des embranchements dendritiques (Magarinos et al. 1996, Woolley et al. 1990). L'expression de la LTP et de la mémoire spatiale sont également perturbés par ce type de manipulation (de Quervain et al. 1998, McEwen et al. 1999). Notons également qu'un stress prolongé peut aller jusqu'à la mort neuronale (Stein-Behrens et al. 1994), ce qui pourrait expliquer la diminution du volume hippocampal observée chez des vétérans de la guerre du Vietnam ainsi que chez des personnes agées (Lupien et al. 1998). Ces effets sont corrélés à la concentration sanguine de corticostéroïdes (Lupien et al. 1998) et sont, dans certains cas, réversibles par une ablation de la glande surrénale, une diminution de la synthèse des corticostéroïdes (de Quervain et al. 1998), ou encore la fin de l'élément stressant (Sousa et al. 2000). Enfin, bien que le lien avec le stress ne soit pas établi, des observations récentes montrent que des différences de soins maternels procurés chez le rat nouveau-né peuvent influencer son développement neuronal et cognitif ainsi que la synaptogenèse dans l'hippocampe (Caldji et al. 1998, Liu et al. 2000).
Modifications liées à l'activité
Parmi les premières observations d'un lien entre la structure des épines et l'activité neuronale figurent des études menées sur des animaux hibernants tels que la marmotte et l'écureuil. Ces études ont montré que des différences de la morphologie des épines entre l'état d'hibernation et l'état d'éveil pouvaient déjà être visibles 2 heures après l'éveil. La tête de l'épine devient moins large et le cou moins épais chez les animaux éveillés (Boycott et al. 1988), ce qui pourrait se traduire par une augmentation de la conductance. D'autres études ont également montré que les dendrites sont plus nombreux et ont plus d'embranchements ainsi qu'une plus grande densité d'épines (Popov et al. 1992). Ces observations sont toutefois relativement difficiles à mettre en relation avec l'activité, l'hibernation faisant intervenir de nombreux processus physiologiques extrêmement complexes.
Plus tard, une observation plus directe de la plasticité morphologique des épines dendritiques est apparue avec la microscopie confocale. En liant à l'actine une protéine fluorescente, la GFP, le groupe de Matus a observé que cet élément du cytosquelette des épines de l'hippocampe de rat était continuellement en mouvement et pouvait changer de forme en l'espace de quelques secondes (Fischer et al. 1998). Plus étonnant encore, lorsque les cultures d'hippocampe sont traitées avec un anesthésiant (Kaech et al. 1999), ou des agents qui interfèrent avec la polymérisation de l'actine (Fischer et al. 1998), les épines cessent tout mouvement. De plus, de telles molécules diminuent l'activité synaptique ainsi que les propriétés de plasticité synaptique (Kim et al. 1999, el-Beheiry et al. 1989, Collins et al. 1988). Enfin, des études de microscopie électronique menées sur des cultures dissociées de neurones pyramidaux ont permis de montrer qu'une augmentation de l'activité excitatrice produisait une augmentation de la proportion de synapses perforées (Neuhoff et al. 1999). Ces résultats, avec la récente observation qu'une entrée de calcium à travers les canaux NMDA est requise pour dépolymériser les filaments d'actine (Halpain et al. 1998), indiquent que l'activité synaptique pourrait modifier le cytosquelette des épines activées et provoquer un remodelage de la membrane postsynaptique, ce qui pourrait contribuer à modifier en retour l'activité synaptique. De récentes expériences montrent toutefois qu'une application de glutamate sur des neurones pyramidaux isolés ou en culture organotypique stoppent de manière drastique la motilité des épines dendritiques (Fischer 2000). Bien que ces expériences renforcent l'hypothèse d'un lien entre l'activité et la motilité synaptique, elles soulèvent la possibilité que, selon le modèle étudié et l'état développemental des synapses, un même traîtement puisse avoir des effets opposés.
Pendant longtemps, il a également été postulé que le nombre d'épines devait augmenter afin de répondre à une hausse de l'activité électrique. Toutefois, diverses études indiquent que ces structures peuvent soit augmenter, soit diminuer selon le degré d'activation synaptique (McAllister et al. 1996, Maletic-Savatic et al. 1999, Rocha et al. 1995, Robinson et al. 1999). De plus, de récentes études indiquent que, dans des tranches d'hippocampe de rat adulte, la formation de nouvelles épines est induite par différents traitements inhibiteurs de l'activité nerveuse tels que : un bloc des canaux sodiques par la TTX, un bloc des récepteurs postsynaptiques par des antagonistes spécifiques (CNQX, APV) ou encore une diminution de l'activité des récepteurs NMDA par diminution du calcium et augmentation du magnésium extracellulaires (Kirov et al. 1999, 1999). Cela suggère que la formation d'épines puisse compenser le manque d'afférences synaptiques. Cette interprétation est toutefois en contradiction avec d'autres expériences montrant qu'une diminution de l'activité provoque une diminution du nombre d'épines : une lésion des afférences hippocampales provoque une diminution du nombre d'épines de la même manière qu'un bloc de la libération vésiculaire par la toxine botulinique ou un bloc des récepteurs AMPA par le NBQX, alors qu'un bloc de l'influx nerveux par la TTX n'induit pas de changement (McKinney et al. 1999). Toutefois, une information importante apportée par cette dernière étude est que les épines dendritiques semblent être maintenues par une activité des récepteurs AMPA, même infime, comme dans le cas de libération vésiculaire spontanée. Cela indique que le neurotransmetteur peut servir de facteur trophique et que son action sur les récepteurs AMPA peut signaler à la cellule postsynaptique qu'une synapse existe. Un tel mécanisme semble également exister au niveau de la jonction neuro-musculaire, où une activation directe du muscle permet d'éviter la rétraction totale des synapses suite à une lésion axonale (Lomo et al. 1972).
Ainsi, il semble que l'activité synaptique puisse influencer autant la forme que le nombre d'épines. La variabilité des réactions à un même traitement pharmacologique ou électrique ainsi que les contradictions d'une étude à l'autre pourraient dépendre du modèle étudié, de son état développemental et physiologique et refléterait ainsi la diversité fonctionnelle des épines selon leur maturation ou leur localisation. Au sein d'une même cellule de Purkinje, par exemple, il a été observé que les épines des dendrites proximales sont maintenues par l'activité électrique, alors que celles des dendrites distales en sont indépendantes (Bravin et al. 1999). Il a également été proposé que le calcium intracellulaire pouvait avoir des effets contradictoires selon sa concentration (Segal et al. 2000, Harris et al. 1999) : une activation synaptique minimale est requise pour maintenir les épines, une augmentation modérée de calcium cause la formation des épines et une forte augmentation cause leur rétraction (Luscher et al. 2000).
Il semble cependant communément admis que, pour des neurones hippocampaux adultes, une augmentation de l'activité induise des modifications morphologiques qui soutiendraient cette augmentation. L'entrée de calcium au niveau postsynaptique pourrait jouer un rôle central dans ce mécanisme.
Modifications liées à l'expérience
Différents types d'expériences acquises, ainsi que l'activité neuronale liée à un comportement complexe peuvent avoir une influence sur la morphologie des épines : l'apprentissage moteur, visuel, olfactif et auditif, la mémorisation spatiale, un environnement matériellement ou socialement complexe ou encore diverses formes de conditionnement.
Un des exemples les plus étudiés est probablement les modifications morphologiques induites par l'exposition d'un animal à un environnement complexe. Chez le rat, plusieurs jours d'entraînement de certaines aptitudes physiques, ou d'exposition à un environnement comportant des objets variés et permettant l'exploration, induisent des modifications majeures de la structure de différentes aires corticales telles que : une augmentation de la longueur et du nombre d'embranchements dendritiques (Volkmar et al. 1972), de la surface de contact entre les cellules gliales et les synapses (Jones et al. 1996), une augmentation du nombre de synapses par neurone et du nombre de synapses perforées (Rampon et al. 2000, Greenough et al. 1978, 1985), du nombre d'épines branchées (Comery et al. 1996), ainsi qu'une augmentation de la taille de la densité postsynaptique (Mollgaard et al. 1971). Des modifications morphologiques similaires ont été observées dans l'hippocampe suite à différents processus d'apprentissage spatial et associatif : une augmentation du nombre de synapses (Moser et al. 1994), du nombre de synapses perforées (VanReempts et al. 1992), une modification du réseau synaptique (Rusakov et al. 1997) et des embranchements dendritiques (Vozeh et al. 1996) ou encore une augmentation de la longueur de la densité postsynaptique (Geinisman et al. 2000).
Un autre exemple est la formation du cortex en tonneau. Cette zone du cortex somatosensoriel, où chaque groupe de neurones constituant une structure en forme de tonneau est liée à une vibrisse, est particulièrement sensible à l'expérience chez les mammifères. Chez un rat nouveau-né, si toutes les vibrisses sont coupées sauf une, une grande zone du cortex somatosensoriel va devenir sensible à l'activation de cette vibrisse (Fox et al. 1994), une réorganisation neuronale qui semble dépendre des récepteurs NMDA et probablement de l'expression de la LTP (Schlaggar et al. 1993). De plus, 1 à 3 jours après avoir sectionné une vibrisse, les neurones correspondant montrent une diminution de la motilité de leurs épines dendritiques (Lendvai et al. 2000).
L'apprentissage du chant des oiseaux induit également des modifications structurelles dans le cortex dédié à cette tâche, le centre vocal, telles que la formation de nouvelles synapses (Nordeen et al. 1997). Il est intéressant de voir que le nombre de synapses générées est proportionnel à la complexité de l'apprentissage du chant (Airey et al. 2000), que l'apprentissage se fait, comme chez l'homme pour le langage, plus facilement durant une période postnatale critique, qu'il est limité et que les capacités d'apprendre un nouveau chant ou un nouveau langage sont inhibées par des hormones de la puberté (Doupe et al. 1999).
Un autre modèle d'apprentissage communément étudié est le réflexe conditionné de rétraction du siphon chez l'aplysie, un mollusque marin. Bien que les mécanismes impliqués soient différents de ceux des vertébrés, les même types de modifications morphologiques ont été mis en évidence dans ce modèle : une augmentation du nombre de vésicules et du nombre de boutons axonaux, ainsi que de leur taille (Bailey et al. 1989).
Tout récemment, une modification morphologique inattendue dans le cerveau des mammifères a été mise en évidence dans l'hippocampe suite à l'exposition à un environnement complexe : la formation de nouveaux neurones. Bien qu'un dogme de la neurobiologie moderne soit que tous les neurones dont dispose un cerveau de mammifère adulte sont présents dès la naissance, il est apparu récemment que de nouveaux neurones peuvent être générés dans différentes aires du cerveau de primates (Gould et al. 1999), dont l'homme (Eriksson et al. 1998) et que cette production puisse être modulée par la complexité de l'environnement (Kempermann et al. 1997, Gould et al. 1999). La fonction et la connectivité de tels neurones sont encore largement inconnues, mais il est fort probable que la neurogenèse contribue aux phénomènes de plasticité des connexions synaptiques et du réseau neuronal nécessaires à l'apprentissage. Elle a en effet déjà observée dans le centre vocal des oiseaux suite à l'apprentissage du chant (Nordeen et al. 1997) et lors du réflexe conditionné de rétraction du siphon de l'aplysie (Glanzman et al. 1990).
Modifications liées à la LTP
Suite à leurs observations du système nerveux central, Ramon y Cajal (1893) et Tanzi (1893) avaient déjà suggéré que des changements dans le nombre et/ou la morphologie des épines pouvait constituer une base cellulaire de l'apprentissage et de la mémoire. Mais ce n'est qu'à partir des années 1970 qu'apparurent les premières observations de modifications morphologiques consécutives à l'expression de la LTP. Un élargissement de la tête et du cou ainsi qu'un raccourcissement de l'épine dendritique a été observé suite à des stimulations à haute fréquence dans le CA1 de l'hippocampe (Fifkova et al. 1977, 1981). Selon des modèles mathématiques, de telles modifications pourraient induire une réduction de la résistance des courants synaptiques et donc participer à l'augmentation de l'efficacité de la transmission synaptique (Miller et al. 1985). Ces résultats sont cependant controversés puisqu'ils n'ont pas pu être observés lors d'autres études plus récentes.
Une modification morphologique qui a pu être observée de manière plus fréquente suite à l'induction de la LTP, est une augmentation de la proportion de synapses avec une densité postsynaptique (PSD) perforée (Schuster et al. 1990, Geinisman et al. 1989, 1991, 1992, 1993). Comme nous l'avons vu précédemment, une synapse perforée est définie par la présence d'une discontinuité dans la PSD et donc dans la répartition des récepteurs postsynaptiques. Par reconstruction en 3 dimensions, les travaux de Geinisman (1991, 1992, 1993) ont permis de montrer que cette perforation était principalement de type segmenté. Il a ainsi été proposé un modèle selon lequel une épine de type simple, non perforée, se transformerait en épine de type maculée, puis en U et enfin segmentée (Fig. 10). Bien que ces résultats représentent un intérêt certain et permettraient d'expliquer dans une certaine mesure le maintien à long terme de la LTP, ils n'ont pas pu être reproduits par des études plus récentes (Sorra et al. 1998).
Toutefois, un aspect technique de ce type d'études morphologiques pourrait expliquer le manque de reproductibilité des résultats d'un laboratoire à l'autre : les analyses ont été effectuées de manière statistique sur des tissus stimulés puis fixés, sans procéder à une identification des synapses activées. Or une étude récente indique que lors de l'induction de la LTP, seules 10 % des synapses totales sont stimulées (Buchs et al. 1996). De plus, si l'on considère que seule une fraction des synapses stimulées exprime des modifications morphologiques, les chances de détecter de tels changements sans identifier les synapses stimulées sont très faibles. Pour tenter de contourner ce problème, notre laboratoire a mis au point une technique permettant de précipiter le calcium et de le rendre électron-dense et donc visible à l'aide du microscope électronique (Buchs et al. 1994). Cette technique permet de visualiser le calcium sous la forme de granules dans des organelles de stockage ainsi que dans les épines dendritiques suite à l'induction de la LTP. De plus, elle permet de détecter une augmentation, dépendante du NMDA, du nombre d'épines marquées suite à l'induction de la LTP, indiquant que les épines marquées représentent un groupe de synapses ayant une plus forte chance d'avoir été stimulées. A l'aide de ce moyen d'identification, il a été possible de mettre en évidence que la LTP était suivie d'une augmentation de 300 % de la proportion d'épines perforées (Buchs et al. 1996), qui finissent par représenter environ 80 % des synapses stimulées, 30 minutes après l'induction de la LTP. Ce type de synapse présente souvent un spinule s'étendant parfois assez loin dans l'axone, provoquant ainsi une compartimentation marquée des vésicules présynaptiques. Ces synapses possèdent alors de multiples sites de libération vésiculaire, ce qui pourrait leur procurer une plus grande efficacité.
Une autre hypothèse permettant d'expliquer le rôle des synapses perforées dans l'expression de la LTP est qu'elles représentent une étape intermédiaire dans la formation de nouvelles synapses (Nieto-Sampedro et al. 1982, Carlin et al. 1983, Luscher et al. 2000). Une épine simple, en se fractionnant dans le sens de la longueur, pourrait former une nouvelle épine. Toutefois cette hypothèse reste très controversée, car il n'a pas été possible d'observer des épines de forme intermédiaire entre une épine perforée et deux épines, à savoir des épines branchées dont les deux têtes contactent le même axone. Au contraire, toutes les épines branchées reconstruites en trois dimensions contactent des axones différents (Trommald et al. 1997, Sorra et al. 1998).
Une autre possibilité est que les synapses perforées résultent de l'insertion de récepteurs dans la membrane postsynaptique. En effet, il a été observé que la LTP induit la synthèse de récepteurs AMPA (Nayak et al. 1998) et qu'un bloc de la machinerie postsynaptique responsable de l'exocytose inhibe l'expression de la LTP (Lledo et al. 1998), ainsi que l'expression des récepteurs AMPA à la surface membranaire (Nishimune et al. 1998, Noel et al. 1999, Song et al. 1998). De plus, les épines perforées présentent plus de récepteurs AMPA à leur surface que des épines simples non perforées (Nusser et al. 1998, Desmond et al. 1998). Il est envisageable que l'insertion de récepteurs dans la PSD puisse provoquer un remodellage des membranes postsynaptiques ainsi que du réseau de protéines qui contribuent à assembler les récepteurs en face de la zone active et induire de cette manière une perforation de la densité postsynaptique (Muller et al., sous presse).
Différentes études ont tenté de déterminer si la LTP pouvait induire la formation de nouvelles synapses. Bien que certaines d'entre elles aient pu mettre en évidence une augmentation du nombre de synapses après l'induction de la LTP (Lee et al. 1980, Chang et al. 1984, Desmond et al. 1986) et indiquent que la synaptogenèse semble liée à une phase tardive de la LTP (Weeks et al. 1998, 1999, Geinisman et al. 1996), ces résultats n'ont pas pu être reproduits par d'autres études (Geinisman et al. 1991, Sorra et al. 1998) et restent controversés car ils reposent sur de très faibles différences. Toutefois, de récents travaux menés à l'aide de la microscopie confocale à deux photons ont permis de mettre en évidence que la LTP était suivie par un bourgeonnement des dendrites stimulées (Engert et al. 1999). En inhibant l'expression de la LTP à l'exception d'une petite zone délimitée par le lavage des substances bloquantes à l'aide d'une sonde de microperfusion, ce groupe a observé que les dendrites inclues dans cette zone formaient des petites protrusions de type filopodial, 30 à 60 minutes après induction de la LTP. Ces filopodes n'étaient que rarement observés hors de la zone où la LTP était possible, indiquant qu'ils étaient liés à la potentiation. Enfin, il est apparu que ce phénomène est extrêmement rapide : 2 minutes environ suffiraient pour former un nouveau filopode. Malheureusement, les techniques employées pour réaliser ce travail ne permettent pas de déterminer si les filopodes aboutissent à la formation d'une synapse mature et fonctionnelle.
Ensemble, ces différentes études indiquent que des traitements aussi variés que des modifications hormonales, des traitements pharmacologiques, des lésions, différentes formes d'apprentissage et d'acquisition d'expérience et la LTP, sont accompagnés de variations de la structure des synapses, qui s'expriment principalement au niveau postsynaptique. De plus, dans toutes ces études, les modifications morphologiques sont invariablement accompagnées de modifications de l'activité et de la transmission synaptique et semblent dépendre plus étroitement de lois dictées par le fonctionnement de la synapse que par le modèle étudié. Il semble enfin que l'expression de ces différentes formes de plasticité synaptique mettent en jeu des mécanismes, autant morphologiques que biochimiques, qui sont impliqués dans l'élaboration des réseaux synaptiques lors du développement du système nerveux central.
Ces observation renforcent l'hypothèse, déjà ancienne, que la structure de la synapse influence sa fonction et que l'utilisation d'une synapse peut, en retour, modifier sa structure.
Résultats, objectifs et résumé de ce travail
Comme mentionné précédemment, une difficulté majeure dans l'étude des modifications morphologiques induite par la LTP réside dans l'identification des synapses potentiées. Afin de contourner ce problème, notre laboratoire a mis au point une technique de microscopie électronique permettant, durant la fixation, de précipiter et ainsi de le rendre visible, le calcium accumulé dans des organelles de stockage. Cette technique s'est avérée particulièrement efficace et a permis, lors d'une première étude, d'identifier et d'observer la morphologie des synapses ayant une forte probabilité d'être stimulées après induction de la LTP dans des cultures organotypiques d'hippocampe. Il a ainsi été possible de déterminer que, 30 minutes après l'induction de la LTP, environ 80 % des synapses stimulées présentaient une perforation de la densité postsynaptique (Buchs et al. 1996).
Le but du présent travail a été dans un premier temps de caractériser le lien entre l'induction de la LTP et la perforation. Plus précisément, il s'agissait de déterminer si la perforation de la densité postsynaptique est effectivement induite par la LTP ou si une stimulation dans des conditions ne permettant pas l'expression de la LTP peuvent également induire des modifications morphologiques des synapses activées.
Dans un deuxième temps, nous avons tenté de caractériser l'évolution temporelle d'une telle modification morphologique. Il s'agissait notamment de déterminer d'une part si les synapses perforées sont issues d'une modification de la densité postsynaptique des épines simples, non perforées et surtout de déterminer si la perforation représente un stade stable, voire final dans la série de modifications morphologiques induites par la LTP.
Enfin, nous avons effectué une étude morphométrique de ces modifications morphologiques, tant en deux dimensions sur des coupes fines de microscopie électronique, que sur des images virtuelles en trois dimensions, reconstruites à partir de coupes sériées.
Les résultats de ces travaux ont fait l'objet de deux publications qui sont présentées ici sous leur forme publiée ou soumise.
Dans la première publication, nous présentons nos résultats concernant l'évolution temporelle des modifications morphologiques induites par la LTP. Différentes cultures organotypiques d'hippocampe ont été fixées suite à une potentiation d'une durée allant de 5 minutes à 2 heures et les synapses de la région stimulée, le CA1, ont été classifiées selon leur forme. Conformément aux précédents travaux, nous avons observé une augmentation massive de la proportion de synapses perforées, 30 minutes après induction de la LTP. Cependant, contrairement à nos attentes, les synapses perforées semblaient n'être que transitoires, puisque leur proportion est revenue à un niveau basal après 1 heure. Tout aussi surprenant, il semble que 45 minutes après l'induction de la LTP survient une augmentation de synapses à épines multiples (MSB), dont la proportion atteint un maximum à 1 heure et reste stable en tout cas jusqu'à 2 heures. En reconstruisant ces synapses en 3 dimensions, il s'est avéré que cette augmentation est essentiellement due à des épines dupliquées, c'est à dire provenant de la même dendrite. Enfin, ces modifications morphologiques semblent liées à l'expression de la LTP, car elles ne touchent que les synapses contenant un précipité de calcium et ne sont plus observables lorsqu'une stimulation est effectuée en présence de différents inhibiteurs de la LTP. Ainsi, il semble non seulement que l'induction de la LTP puisse aboutir à la formation de nouvelles synapses d'apparence mature, mais également que ces synapses se forment précisément sur un terminal axonal activé, permettant de dédoubler une synapse active ce qui pourrait induire une augmentation de l'efficacité de la transmission synaptique de manière stable.
Cette étude soulève la possibilité que les synapses simples puissent se perforer, puis contribuer d'une certaine manière à la formation des nouvelles épines. Afin d'explorer cette possibilité et d'en mieux comprendre les mécanismes, nous nous sommes intéressés, dans la deuxième étude présentée, à différents paramètres morphologiques des types de synapses observés après l'induction de la LTP. A l'aide de programmes d'analyse morphométrique et de reconstruction tri-dimensionnelle, nous avons mesuré des paramètres tels que la surface de la tête de l'épine, la surface recouverte par la PSD, la longueur du spinule, la forme de la PSD et la présence de vésicules coatées dans l'épine. Il en ressort d'une part que l'augmentation de la proportion de synapses perforées observée 30 minutes après induction de la LTP était essentiellement due à une augmentation de synapses avec des PSD segmentées, c'est à dire entièrement séparées par une zone dépourvue de densité. Ce type particulier de synapses semble caractérisé par un grand spinule associé à la PSD, ainsi que par une forte teneur en vésicule coatées d'exo/encdocytose, ce qui suggère que d'intenses mouvements membranaires s'effectuent au sein de ces synapses. Enfin, les épines dupliquées observables dès 45 minutes après induction de la LTP ont une plus petite PSD que les synapses simples et une plus faible proportion de synapse perforée, ce qui pourrait être un signe de leur relative immaturité. Ainsi, il semble que la LTP induise un remodelage de la PSD et des membranes postsynaptiques, qui pourrait aboutir à la duplication des épines.