I. Revue générale
1. Epidémiologie
La maladie thromboembolique, et plus particulièrement l'embolie pulmonaire (EP) qui fait l'objet de ce travail, a été décrite pour la première fois il y a plus d'un siècle environ par l'anatomo-pathologiste allemand von Virchow (1). Il est le premier à avoir évoqué l'association entre thrombose veineuse profonde (TVP) et EP ; il est également à l'origine de la première explication physiopathologique de la formation du thrombus selon la triade : stase veineuse, lésion vasculaire et hypercoagulabilité. Depuis lors, cette maladie a fait l'objet de très nombreuses études aussi bien épidémiologiques que cliniques. Actuellement, l'EP demeure un problème de santé important car, malgré les progrès des technologies médicales, elle est encore souvent mortelle et sous-diagnostiquée.
La Suisse ne dispose malheureusement pas de données épidémiologiques récentes : une seule étude sur des données datant de 1920 à 1980 montrait un taux de mortalité entre 0,02 et 0,05/10'000 habitants / an (2). Par contre, des données actuelles existent aux Etats-Unis et on rapporte le plus souvent les chiffres estimés par Dalen (3) de 630'000 cas d'EP symptomatiques par année représentant 300'000 hospitalisations. Le nombre de décès directement provoqués par l'EP varie de 50'000 à 100'000 selon les auteurs (3,4). Ces données font de l'EP la troisième cause de décès cardio-vasculaire après l'infarctus du myocarde et l'accident vasculaire cérébral.
Une façon plus précise d'évaluer l'impact d'une maladie est d'en connaître l'incidence, la mortalité et la prévalence dans la population. Estimer le nombre de cas d'EP est relativement difficile puisque ses symptômes et signes cliniques sont peu spécifiques et qu'elle est la cause de nombreux décès subits sans qu'un diagnostic n'ait le temps d'être posé. Elle peut être également tout à fait asymptomatique lors de thrombose veineuse profonde proximale associée, par exemple (5,6). En effet, la TVP et l'EP sont deux aspects cliniques d'une même maladie : la maladie thromboembolique veineuse (MTEV). On a démontré leur association d'abord à l'autopsie lors d'EP fatale (7), puis par la présence de TVP phlébographique chez 70 % des patients avec une EP confirmée (8). Enfin, la recherche d'EP asymptomatique par scintigraphie lors de TVP aiguë confirmée est positive dans 40 à 60 % des cas (6,9). La principale origine d'une EP est une TVP des membres inférieurs symptomatique ou non ; peu d'EP (environ 10 % à peine) surviennent après une thrombose des veines des membres supérieurs ou des veines abdominales ou pelviennes.
De nombreux travaux aux méthodologies différentes ont été publiés sur l'épidémiologie de la maladie thromboembolique. Certains sont des études à partir de certificats d'autopsies ou de certificats de décès, d'autres des revues de diagnostics de sortie d'hôpitaux : ces travaux portent exclusivement sur une population hospitalisée et sont des travaux rétrospectifs. Les études de cohorte menées de façon prospective sur une population générale d'un lieu géographique limité donnent un reflet plus exact de la réalité. Enfin, des registres de patients qui évaluent le devenir à long terme des patients ayant eu une EP ont été constitués. Ces études seront citées brièvement pour donner un aspect global de l'impact de l'EP sur la santé de la population.
1.1.Etudes autopsiques
Les travaux les plus anciens sont des études anatomo-pathologiques portant sur des certificats d'autopsie. Ce type d'études permet de déterminer la mortalité et la prévalence de l'EP à l'intérieur d'une population hospitalisée. Un bon exemple en est l'étude de Bergqvist (7) réalisée à Malmö, entre 1951 et 1980 : cette ville suédoise est desservie par un hôpital unique qui a maintenu un taux exceptionnellement haut d'autopsies (entre 77 et 97 %) durant les trente années de l'étude. La prévalence à l'autopsie de l'EP (certificats d'autopsie mentionnant la présence d'une EP) était de 23,6 % chez des patients chirurgicaux opérés ou non et n'a que peu varié durant cette période. Dans les premières années de l'étude, Bergqvist relève une augmentation de la fréquence d'EP fatales qu'il attribue à une augmentation du nombre de patients âgés opérés (grâce à l'amélioration des techniques chirurgicales et anesthésiologiques à cette époque). Ces patients sont, en effet, à plus grands risques de complications thromboemboliques. Dans les dernières années de l'étude, la fréquence d'EP fatales diminue au profit des EP contribuant au décès, possiblement en rapport avec l'usage plus répandu de la prophylaxie anti-thrombotique. L'auteur relève, toujours dans les dernières années, une augmentation du délai entre la survenue d'événements thromboemboliques et le jour de l'admission ceci probablement en raison de la prophylaxie utilisée dans le post-opératoire immédiat puis de son arrêt trop précoce dû au raccourcissement des durées de séjour. Parmi les patients chirurgicaux hospitalisés, la prévalence globale de l'EP fatale était de 0,8 % avant l'usage de la prophylaxie. Avec l'usage de la prophylaxie, Bergqvist constate une diminution de la prévalence de l'EP de 0,8 à 0,6 %, avec toutefois la réserve déjà mentionnée sur le nombre de cas autopsiés. Ceci est confirmé par d'autres auteurs qui retiennent une prévalence d'EP sous prophylaxie de 0,4-0,6 % (10). La maladie thromboembolique apparaît donc comme une menace persistante chez les patients hospitalisés.
Une autre étude (11) portant sur les certificats d'autopsie de l'hôpital Henry Ford de Boston participant à l'étude PIOPED a montré une prévalence plus basse à l'autopsie d'environ 14,6 %, alors qu'elle est de 23 % en Suède (avec un taux toutefois beaucoup plus faible d'autopsies qu'à Malmö : 80 % en Suède contre 18 % à Boston). La prévalence d'EP fatales chez les patients hospitalisés s'élève à 0.3 %. Le mérite de cette étude est d'avoir attiré l'attention sur le fait que le diagnostic d'EP n'avait été suspecté que chez 30 % de patients pour lesquels l'EP était la principale cause de décès, données que l'on retrouve dans une autre revue de certificats d'autopsies (12) faite quelques années auparavant. L'étude de Goldhaber et coll. (13) dans les années septante revient sur ce problème et montre que seuls 30% des patients décédés d'EP avait eu un diagnostic posé ante-mortem. Ce pourcentage est plus élevé chez des patients chirurgicaux opérés ou en cas de symptômes de TVP associés mais il n'est que de 0 à 10% chez les patients médicaux âgés, et en cas de pneumonie associée. En effet, les patients âgés atteints d'insuffisance cardiaque ou respiratoire comme les patients souffrant de pneumonie présentent une symptomatologie qui masque souvent partiellement, voire totalement, celle d'une EP sous-jacente.
Ces études incitent donc à garder un haut degré de suspicion clinique de la maladie chez les patients hospitalisés et à instaurer de manière large une prophylaxie antithrombotique dans les populations à risque, aussi bien dans les services de médecine que de chirurgie. Elles n'apportent pourtant qu'une information limitée, car non seulement l'autopsie ne concerne que des patients hospitalisés, mais encore elle peut sous-estimer la présence d'EP suivant la technique utilisée (autopsie pratiquée en recherchant minutieusement des emboles par dissection vasculaire, en utilisant une angiographie pulmonaire post-mortem associée à une insufflation des poumons avant fixation (14)). De plus, il est relativement difficile et subjectif de se prononcer sur la contribution d'une EP non massive au décès (facteur contributif ou événement accompagnant l'agonie).
1.2. Etudes de diagnostics de sortie d'hôpitaux et de certificats de décès
Une autre façon d'étudier l'impact de la maladie thromboembolique est d'examiner rétrospectivement des certificats de décès et des listes de diagnostics de sortie d'hôpitaux. Ces études ne concernent donc qu'une population de patients hospitalisés. Stein et coll. ont récemment mené un tel travail (15) : ils ont étudié les patients sortis de l'hôpital avec le diagnostic d'EP posé soit par une scintigraphie de forte probabilité soit par une angiographie pulmonaire. Cette étude ne prend pas en compte les EP retrouvées à l'autopsie ni les EP asymptomatiques. Le nombre de cas sur les quatre années est de 400 (sur 175'000 hospitalisations) : l'incidence dans ce groupe de patients est donc de 6/10'000 patients / an. Stein relève que l'incidence est linéairement reliée à l'âge chez ces patients.
Lilienfeld et coll. ont revu des certificats de décès enregistrés entre 1962 et 1984 (16) et ont retrouvé, comme Stein, une augmentation linéaire du nombre de diagnostics d'EP avec l'augmentation de l'âge. Dans cette étude la mortalité de l'EP suit la même tendance avec l'âge ; en revanche, la mortalité globale de l'EP a diminué au cours des années quatre-vingts.
Une étude publiée par Huber et Bounameaux (17) porte sur la prévalence d'EP survenant pendant et après (suivi de 30 jours) un séjour dans la Clinique de Chirurgie Digestive de l'Hôpital Cantonal de Genève (seul établissement public du canton) chez 28'953 patients sur une période de 10 ans. La prévalence globale observée (avec usage de prophylaxie durant le séjour) est de 0,31% à l'hôpital et de 0,42% à l'hôpital et 30 jours après la sortie. Ces chiffres sont trois fois plus élevés s'il y a eu une intervention chirurgicale durant le séjour, six fois plus s'il y a un cancer sous-jacent. Il faut également remarquer que 30% des événements sont survenus après la sortie de l'hôpital, touchant également des patients jeunes et des patients ayant subi une intervention chirurgicale bénigne. Aussi, les auteurs évoquent la possibilité de prolonger la prophylaxie afin de prévenir la survenue de ces événements tardifs, un débat qui est encore très actuel.
1.3. Etudes de cohorte
Enfin, ces dernières années, des études ont été publiées portant sur des populations géographiques limitées qui permettent d'extrapoler des chiffres pour la population générale.
La Worcester Study est une étude intermédiaire entre étude de cohorte et étude rétrospective sur des dossiers médicaux (18). Anderson analyse les diagnostics de sortie de tous les hôpitaux de la région de Worcester, la 2e ville de Nouvelle-Angleterre (380'000 habitants) après Boston. Ce travail permet de calculer des taux d'incidence pour la population hospitalisée et d'extrapoler pour la population ambulatoire. Les taux, probablement sous-estimés en raison des cas asymptomatiques non recherchés et du faible nombre d'autopsies pratiquées, sont de 5,6/10'000 habitants par année pour un premier épisode de TVP et de 2,3/10'000 par année pour un premier épisode d'EP (Figure 1). L'incidence varie beaucoup selon l'âge des patients : contrairement à l'étude de Stein sur les patients hospitalisés, la relation entre âge et incidence chez la population ambulatoire est exponentielle. En revanche, chez les patients hospitalisés de l'étude Worcester, la relation entre l'âge et la survenue d'évènements thromboemboliques est linéaire comme l'ont décrite Stein et Lilienfeld (15,16).
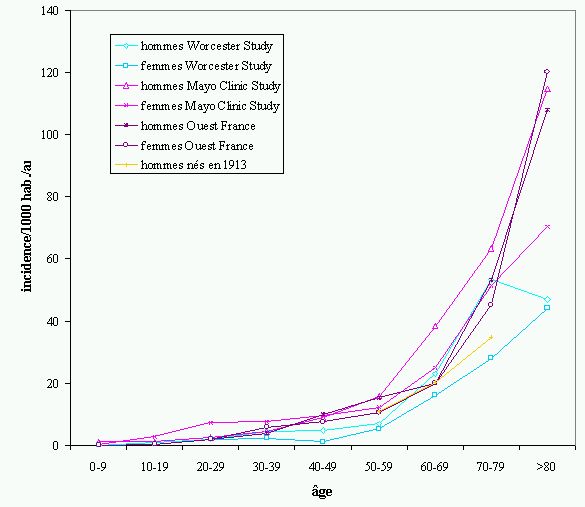
Un dernier type d'étude est l'étude de cohorte menée de façon prospective sur une population générale. C'est le type d'étude le plus performant pour mettre en évidence des facteurs de risque pour le problème de santé étudié : elle permet de confirmer des relations de cause à effet entre différents facteurs associés mis en évidence dans des études rétrospectives. La connaissance des facteurs de risque de maladie dans la population générale permet de mettre en place des mesures de préventions primaires afin de diminuer l'incidence de la maladie dans la population et d'en diminuer la mortalité. Ce type d'étude permet aussi d'analyser des tendances au cours du temps, notamment les variations du taux d'incidence, les récidives de la maladie et leurs facteurs de risque. Une telle étude, publiée récemment en plusieurs parties (19-21), est celle de la Mayo Clinic qui a suivi sur l'ensemble de la population du comté d'Olmsted (Minnesota, USA) des patients ayant eu un diagnostic d'EP ou de TVP entre 1966-1990 (19-21). Le diagnostic pouvait avoir été posé lors d'un séjour à l'hôpital ou lors d'une consultation ambulatoire. L'étude rapporte une incidence différente de l'étude Worcester mais peut-être plus réaliste : 4,8/10'000/an pour la TVP et 6,9/10'000/an pour l'EP (Figure 1). Cette étude montre, comme l'étude Worcester, une relation exponentielle de l'incidence avec l'âge puisque avec un doublement chaque dizaine d'années dès 55 ans. Grâce à une très longue période de suivi, les auteurs ont pu déterminer la variation de l'incidence : celle-ci diminue pour l'embolie pulmonaire (mais le taux d'autopsie à la Mayo Clinic également) tandis qu'elle reste stable ces trente dernières années pour la TVP. De cette dernière étude on peut déduire une incidence pour la maladie thromboembolique tous âges confondus et tous facteurs de risque confondus de 1 / 1000 / an : le taux d'incidence de la maladie atteint en fréquence celui de l'accident vasculaire cérébral.
L'étude des « Hommes nés en 1913 »(22), une étude suédoise de cohorte, a également permis de calculer des taux d'incidence qui sont cette fois plus élevés : 18,2/10'000/an pour la TVP, 20,5/10000/an pour les EP fatales et non fatales et 38,7/10'000/an tous épisodes thromboemboliques confondus. La population étudiée dans ce cas avait au moins 50 ans, un âge à partir duquel l'incidence d'événements thromboemboliques augmente dans toutes les études. La population scandinave est connue par ailleurs pour avoir plus d'événements thromboemboliques peut-être parce qu'elle est porteuse d'anomalies de l'hémostase à l'origine d'une thrombophilie dans de plus grandes proportions que les populations américaines et de l'Europe de l'Ouest (23).
Enfin, une étude récemment publiée sur le suivi d'une cohorte appartenant au district de Brest à l'ouest de la France trouve des chiffres d'incidence intermédiaires : 12,4/10'000/an pour la TVP et 6/10'000/an pour l'EP, globalement de 18,3/10000/an (24). Ces chiffres se rapprochent des chiffres suédois et semblent très fiables puisqu'ils prennent en compte, en plus des diagnostics posés dans tous les hôpitaux de la région, les diagnostics faits en dehors des hôpitaux par des angiologues. On constate donc que les chiffres des précédentes études ont plutôt tendance à être sous-estimés.
L'étude de Worcester a montré que la mortalité à l'hôpital de l'EP était plus élevée que celle de la TVP (trois fois plus), que cette mortalité augmentait encore si l'EP ou la TVP accompagnait un autre diagnostic principal. Etant donné que l'étude du comté d'Olmsted comporte un groupe témoin, elle a permis de calculer un excédent de mortalité chez les patients avec maladie thromboembolique de 15% en rapport avec une plus grande fréquence de comorbidités. Les mêmes variations du taux de mortalité au cours du temps que celles mentionnées dans les revues de certificats de décès sont retrouvées dans ces études prospectives. La mortalité a diminué au cours des années quatre-vingts et cette constatation ne s'explique pas entièrement par la diminution du taux d'autopsie. Par contre, il est encore nécessaire d'étendre le recours à une prophylaxie antithrombotique de manière plus systématique et peut-être pour un plus long délai dans les situations à risque, car l'incidence de la MTE ne suit pas la même tendance à la baisse que la mortalité.
1.4. Registres de patients et pronostic de l'EP
Après les études de cohorte qui évaluent l'incidence de la maladie thromboembolique et ses facteurs de risque potentiels, d'autres auteurs se sont intéressés à investiguer le devenir des patients après un diagnostic d'EP au moyen de registres de patients dont les deux principaux sont: celui établi à partir des patients inclus dans l'étude PIOPED (25) et le registre multicentrique ICOPER (26). Ce dernier est établi à partir de patients ayant eu un diagnostic d'EP posé par autopsie, par angiographie, par un résultat scintigraphique de forte probabilité ou par la présence d'une TVP à l'ultrason lors d'une suspicion clinique d'EP.
Les registres ICOPER et PIOPED montrent des taux de mortalité à court terme et long terme relativement comparables pour l'EP : 17,5% contre 15%. Par contre on note une très grande différence entre le nombre de décès attribuables à l'EP dans les deux registres : dans ICOPER, c'est l'EP qui est la grande responsable des décès (dans 45 % des cas) tandis que dans PIOPED c'est le cancer qui est la principale cause de décès (35%), l'EP n'étant qu'une cause rare de mortalité chez ces patients (2%). Cette différence provient du fait que le registre PIOPED est constitué à partir d'une étude qui n'était pas destinée à investiguer la mortalité et le suivi des patients mais à évaluer les moyens de diagnostic de l'EP. Cette étude imposait une angiographie pulmonaire à chaque patient inclus : il semble donc que les patients de PIOPED étaient en meilleur état général (nécessaire pour subir un examen invasif) que les patients de ICOPER qui étaient inclus après que le diagnostic d'EP a été posé de manière objective mais sans moyen diagnostique particulier imposé.
Une analyse multivariée dans ICOPER prédisait comme facteurs de mauvais pronostic, l'hypotension artérielle systolique, l'hypokinésie du ventricule droit à l'échocardiographie, l'insuffisance cardiaque et l'insuffisance respiratoire. L'âge est également un facteur de mauvais pronostic commun à presque toutes les études épidémiologiques.
Un registre de patients a été également constitué à partir des patients inclus dans deux études de Perrier et coll. (27-29). L'analyse multivariée des données concernant ces patients par Wicki et coll. (30) a permis de calculer un score de risque dans lequel on retrouve comme facteurs de mauvais pronostic : la présence d'une néoplasie active, l'hypotension artérielle systolique, l'hypoxémie, la présence d'une TVP échographique concomitante et les antécédents d'EP ou de TVP. L'âge n'a pas été retrouvé dans cette analyse comme facteur de mauvais pronostic.
1.5 Conclusions
Grâce aux différents types de méthodologies employés pour explorer son incidence, sa prévalence, sa mortalité et ses facteurs de risque, on acquiert ainsi une vision globale de l'EP, qu'elle affecte une population générale ou une population hospitalisée. Toutes les études montrent cependant que la maladie thromboembolique continue à être une menace sur la santé. Son incidence varie peu sur ces dernières années, elle semble souvent sous-estimée malgré l'apparition de nouveaux moyens diagnostiques et thérapeutiques. Devant la difficulté de poser un diagnostic rapide et le vieillissement de la population qui est à plus grand risque de maladie thromboembolique, on peut s'attendre à ce que l'incidence augmente encore. Enfin, ces études ont permis de caractériser des facteurs de risque qui seront cités plus loin, et des facteurs de mauvais pronostic. Ceci permet de mieux cerner la population concernée par la maladie. D'autres études seront nécessaires pour évaluer l'indication et l'efficacité des moyens de prévention instaurés en fonction des facteurs de risque. En attendant, il convient d'être attentif et d'investiguer toute situation évocatrice d'une EP sous-jacente.
2. Prise en charge diagnostique
2.1. Les examens diagnostiques
2.1.a Scintigraphie et angiographie
Jusque dans les années soixante, le diagnostic d'EP ne peut être posé avec certitude qu'à l'autopsie, la clinique permettant uniquement de le suspecter. Au début de ces mêmes années, une étude montre le bénéfice de l'anticoagulation comme traitement de l'EP aiguë (31). C'est aussi à la même période que se développent des techniques d'imageries radiologiques qui apparaissent prometteuses pour investiguer la circulation du sang au niveau des poumons : la scintigraphie et l'angiographie pulmonaire.
La scintigraphie consiste en l'injection d'un traceur radioactif (des microagrégats d'albumine marqués au Technetium 99) par voie intraveineuse (phase de perfusion) qui va se répartir dans la circulation, puis emboliser environ 1% du lit vasculaire pulmonaire, permettant ainsi de recueillir une image de la vascularisation pulmonaire par une gamma-caméra. On ajoute, mais pas systématiquement, une phase de ventilation au cours de laquelle le patient respire un gaz radioactif (un aérosol de technétium, le Technegas ou du Xenon). Les images de perfusion et de ventilation sont comparées et le diagnostic d'EP repose sur la présence d'un ou plusieurs « mismatch » segmentaires, c'est-à-dire de défauts de perfusion correspondant à des divisions de l'arbre vasculaire pulmonaire au niveau au moins segmentaire en présence d'une phase de ventilation normale dans le segment considéré.
L'angiographie pulmonaire est réalisée par la ponction d'une veine de gros calibre (fémorale commune le plus souvent, parfois humérale) puis par l'introduction d'un cathéter qui remonte l'arbre veineux jusqu'au coeur droit, puis dans le tronc et les deux artères pulmonaires. Les vaisseaux pulmonaires sont opacifiés sélectivement (injection de produit de contraste directement dans l'artère pulmonaire gauche puis droite) et les images sont réalisées sous plusieurs incidences. Cet examen est considéré comme le gold-standard pour le diagnostic de l'EP (32) mais il est techniquement difficile et la reproductibilité interobservateur de son interprétation n'est pas non plus optimale (de l'ordre de 80%). L'examen n'est pas sans risque pour le patient comme en témoigne le travail publié par Stein lors de l'étude PIOPED (33) qui évalue sa mortalité à 0,5%, des complications sévères pouvant survenir chez 1% des patients et des complications non sévères chez 5%.
A la fin des années soixante, ces techniques nouvelles sont mises à contribution dans une étude sur le bénéfice de la thrombolyse dans l'EP massive. Cette étude de grande envergure (34) se sert de la scintigraphie et de l'angiographie pour confirmer le diagnostic, contribuant ainsi à étendre leur usage et surtout celui de la médecine nucléaire, l'angiographie restant un examen difficile à réaliser et à interpréter, réservé aux centres de référence. Cependant l'enthousiasme pour la scintigraphie pulmonaire comme examen initial est tempéré par Robin (35) à la fin des années septante qui rappelle que les performances en termes de sensibilité et spécificité de la scintigraphie ont été insuffisamment évaluées par rapport au test de référence pour le diagnostic d'EP : l'angiographie pulmonaire.
C'est au début des années quatre-vingts que l'étude qui établira la performance de la scintigraphie sera débutée. L'étude PIOPED, pour Prospective Investigation Of Pulmonary Embolism Diagnosis (36), évalue les performances de la scintigraphie par rapport aux résultats de l'angiographie. L'étude compte 1500 patients ambulatoires et hospitalisés répartis dans deux bras : l'un impose une angiographie à tous les patients inclus et l'autre laisse le choix au médecin en charge de décider s'il faut y recourir ou pas. Sept cent cinquante-cinq patients subissent une scintigraphie et une angiographie. La scintigraphie est interprétée selon des critères prédéterminés et son résultat est rendu sous forme d'une « probabilité scintigraphique » d'EP soit : examen normal, de très faible probabilité, de faible probabilité, de probabilité intermédiaire et de forte probabilité pour une EP. Le diagnostic final et l'introduction d'une anticoagulation sont posés par l'angiographie. L'apport décisif de cette étude a été de montrer que la scintigraphie pulmonaire ne s'avère utile pour confirmer ou infirmer le diagnostic que chez un nombre limité de patients (env. 30%). Une scintigraphie de forte probabilité est associée à une prévalence d'EP à l'angiographie de 88% : elle permet donc de poser le diagnostic et d'introduire une anticoagulation thérapeutique sur la base de ce seul examen. Une scintigraphie normale permet d'écarter le diagnostic avec une sécurité suffisante pour les patients puisque la prévalence de l'EP à l'angiographie n'est que de 4%. Malheureusement l'un ou l'autre cas de figure ne se retrouvent que chez un tiers des patients. Le reste des examens scintigraphiques est constitué d'examens «de probabilité intermédiaire» ou « de faible probabilité ». Ces examens sont considérés comme non conclusifs puisque la prévalence de l'EP à l'angiographie varie entre 12 et 33 %. Ceci impose donc de recourir chaque fois à une angiographie pulmonaire pour un diagnostic de certitude, donc chez 66% des patients.
2.1.b La recherche de TVP : ultrason (US) et pléthysmographie (IPG)
L'EP et la TVP ont une relation physiopathologique qui a été confirmée par des études d'autopsies et par une étude de Hull et coll. démontrant la présence d'une TVP phlébographique chez 70% des patients avec une EP confirmée (8). Il apparaît donc logique de rechercher la présence d'une TVP asymptomatique afin de pouvoir initier un traitement anticoagulant, si l'on en trouve une, sans pratiquer d'autre investigation.
Des examens non invasifs pour la recherche de TVP existent depuis quelques dizaines d'années. Un des plus anciens est la pléthysmographie par impédance (IPG) ou à jauges à mercure. Cette dernière mesure les changements de volume sanguin au niveau des jambes (par des sondes sensibles à la distension) produits par les variations de volume induites par des brassards gonflés autour des cuisses. Cet examen s'est avéré très sensible et très spécifique dans des études datant des années septante et quatre-vingts (de 90 à 100%), pour la détection de TVP proximale lors de suspicion d'EP en comparaison avec le gold-standard qu'est la phlébographie (injection de produit de contraste dans une veine du dos du pied afin d'opacifier tout le réseau veineux de la jambe suspecte) (37,38). Une stratégie diagnostique incluant le recours à une série d'IPG (7 examens au plus) à la place d'une angiographie pulmonaire pour le diagnostic d'EP a été étudiée par Hull et coll. dans une cohorte prospective de patients (39). Elle permet d'éviter un certain nombre d'angiographies chez des patients sans pathologie cardio-respiratoire associée à une IPG normale à plusieurs reprises et une scintigraphie non conclusive, le suivi à long terme montrant un taux faible de mortalité liée à une EP non diagnostiquée et un taux faible de récidive (1,9% du collectif).
Puis, l'ultrason veineux (US) en mode B, parfois associé au Doppler continu ou pulsé, a supplanté les techniques pléthysmographiques,. La non compressibilité de la veine par la sonde d'échographie pose le diagnostic de TVP (40), un flux continu au Doppler est un signe indirect de TVP. Deux études prospectives (41,42) ont comparé IPG et US et ont montré, contrairement aux données publiées auparavant (39) que l'IPG était moins sensible qu'initialement admis. En effet, sa sensibilité est évaluée dans les deux études à 65% tandis que celle de l'US est de 95%. Les spécificités des deux examens restent les mêmes, supérieures à 95%. La recherche de TVP en cas de suspicion d'EP pourrait être très utile, puisqu'elle permettrait d'éviter d'autres examens radiologiques au patient qui serait traité directement après la confirmation du diagnostic. Cependant si les performances de l'ultrason s'avèrent excellentes (sensibilité et spécificité de 95%) en cas de suspicion clinique de TVP, il en va autrement chez les patients asymptomatiques, le cas le plus fréquent chez les patients avec une suspicion d'EP. Une étude, portant sur des patients asymptomatiques ayant subi une intervention orthopédique des membres inférieurs et chez qui une recherche de TVP par US est faite systématiquement, rapporte une sensibilité de 50% (43). Il en irait de même chez les patients suspects d'EP. L'US ne permettrait donc de trouver une TVP que chez 60% des patients ayant une EP et, dans une population avec une suspicion clinique d'EP et une prévalence d'EP de 30 %, on ne pourrait poser le diagnostic d'EP que chez 18% d'entre eux. L'US est donc très utile mais insuffisamment sensible comme examen initial dans une stratégie diagnostique : un examen négatif ne permettant pas d'exclure la présence d'une EP.
2.1.c Le dosage des D-dimères
Par contre, il existe un test très sensible mais peu spécifique pour la MTEV étudié par Bounameaux et coll (44). Il s'agit du dosage des D-dimères, un produit de dégradation de la fibrine, qui témoigne de l'activation de la fibrinolyse concomitante à l'activation de la coagulation lors de la formation d'un thrombus. Le dosage des D-dimères par une méthode ELISA a une excellente sensibilité, de l'ordre de 99% : un taux inférieur à 500 ng/ml rend le diagnostic de maladie thromboembolique improbable avec une valeur prédictive négative de 98%. La spécificité du test est, en revanche, médiocre, elle n'excède pas 45% : en effet, une élévation des D-dimères se rencontre dans beaucoup d'autres situations cliniques, notamment lors d'états inflammatoires et de néoplasie, de plus une élévation progressive du taux survient naturellement avec l'âge. Grâce à sa bonne sensibilité et sa bonne valeur prédictive négative ce test s'avère particulièrement utile comme premier test de dépistage de la MTEV. La méthode ELISA a été automatisée récemment et s'adapte aux situations d'urgence. Il existe également des tests d'agglutination au latex permettant ce dosage : ils sont rapides (deux minutes contre quarante-cinq minutes), meilleurs marché que les tests ELISA et réalisables au lit du patient (45). Cependant, ces tests sont lus en appréciant visuellement l'agglutination : leur performance est examinateur dépendant et le résultat rendu semi-quantitatif. Ils sont moins sensibles pour la maladie thromboembolique veineuse que les tests ELISA, comme l'a montré une grande étude sur près de 1200 patients (46). En effet, le test SimpliRED utilisé montre une sensibilité de 85% qui est insuffisante pour exclure le diagnostic de MTEV, comme le prouvent les résultats de l'étude.
2.2. Stratégies de prise en charge
Depuis quelques années, les cliniciens disposent donc de plusieurs examens (dosage des D-dimères, US veineux, scintigraphie pulmonaire et angiographie) permettant de poser ou d'infirmer le diagnostic d'EP, le gold-standard demeurant l'angiographie pulmonaire. Il s'agit donc de les mettre en place dans une stratégie cohérente. Plusieurs auteurs ont publié des études prospectives de prise en charge, on en citera deux de façon plus détaillée.
Initialement, les stratégies de prise en charge imposaient en général aux patients une évaluation clinique suivie d'une scintigraphie et éventuellement d'une angiographie. Par la suite, les stratégies ont intégré la recherche de TVP de manière non invasive (IPG et US) et certaines ont inclus un dosage des D-dimères.
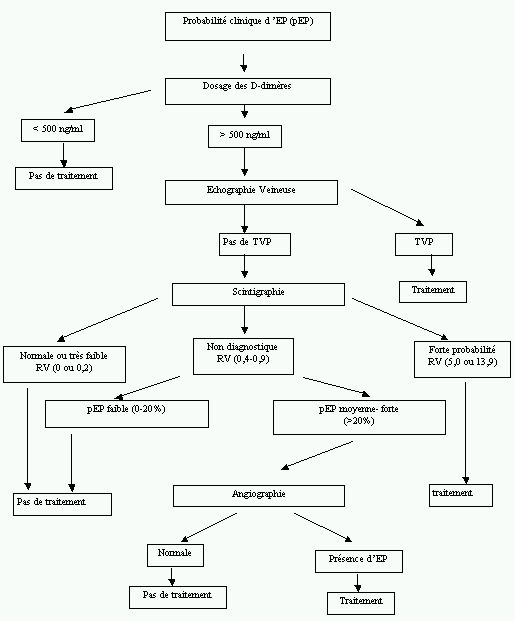
La stratégie proposée par Wells et coll. (47) en 1998, repose sur l'établissement d'une probabilité clinique à priori grâce à un score de risque. Les autres investigations qui suivent l'établissement de la probabilité clinique combinent la scintigraphie, un US veineux sérié (quatre examens sur quatorze jours) ou unique, la phlébographie et l'angiographie pulmonaire. Un schéma (Figure 2) montre cette stratégie : elle s'avère relativement complexe et impose dans certains cas à la fois une phlébographie et une angiographie aux patients. On reviendra plus loin sur les détails de l'appréciation clinique initiale.

L'analyse décisionnelle, appliquée aux situations cliniques par Pauker et Kassirer (48), est une méthode quantitative d'aide à la prise de décision qui a été utilisée par A. Junod pour examiner la place de l'angiographie chez les patients ayant une scintigraphie pathologique (49). Le but en est de définir une stratégie aboutissant à une décision thérapeutique en prenant en compte toutes les conséquences possibles (« issues ») d'une décision clinique, les performances (sensibilité et spécificité) des différents tests pratiqués ainsi que les complications liées aux examens invasifs. On construit un arbre décisionnel dans lequel figurent des branches en fonction des décisions cliniques à prendre (noeuds de décision) et leurs conséquences, soumises aux probabilités (noeuds de chance). Ensuite, on attribue une valeur relative à chaque branche de l'arbre et la branche ayant la meilleure valeur (ou « utilité ») est choisie. Enfin, on choisira la stratégie diagnostique qui a la meilleure valeur relative globale ou « utilité attendue », c'est-à-dire celle qui maximalise les chances d'issues favorables pour le patient. Dans le cas de l'EP, c'est celle qui minimalise le recours à un test invasif sans risquer de manquer le diagnostic et à la fois celle qui évite le recours à un traitement anticoagulant qui ne serait pas nécessaire.
Cette méthode a permis de définir un algorithme de prise en charge basé sur l'établissement de la probabilité clinique et le résultat de la scintigraphie. Deux études (28,29) ont été publiées qui montrent sa validité notamment en termes de réduction du nombre d'examens invasifs nécessaires. Un schéma (Figure 3) montre l'algorithme en question. Le recours à l'angiographie n'a été nécessaire que de 11% des patients puisqu'on ne la pratique qu'en dernier lieu chez les patients avec une probabilité clinique moyenne ou forte et un bilan clinique et paraclinique non conclusif.
Enfin, les prochaines stratégies essaieront d'intégrer un autre examen radiologique, moins invasif et plus largement disponible que l'angiographie : il s'agit du scanner thoracique hélicoïdal avec injection de produit de contraste (angioscanner). Cet examen présente également l'avantage de pouvoir éventuellement montrer d'autres pathologies pulmonaires, pleurales ou médiastinales, responsables des symptômes. L'EP apparaît au CT comme un défaut de remplissage du vaisseau qui peut être central, excentrique ou mural, pouvant être partiellement ou complètement occlusif.
Rémy Jardin (50) s'est intéressé à utiliser le scanner thoracique spiralé avec contraste pour détecter la présence d'emboles dans les vaisseaux pulmonaires : l'examen paraît prometteur car il est rapide, moins invasif que l'angiographie, plus largement disponible que la scintigraphie pulmonaire dans les divers hôpitaux et selon l'auteur d'une bonne sensibilité, permettant d'exclure l'EP sur la base d'un examen ne montrant aucun défaut de remplissage vasculaire au niveau des vaisseaux segmentaires.
Les études portant sur le CT hélicoïdal dans le diagnostic de l'EP ont été récemment revues par deux auteurs (51,52). Dans les études citées la sensibilité du CT varie de 53 à 100% et la spécificité entre 81 et 100%. Cette large variation s'explique par le fait que les études ne remplissaient pas tous les critères nécessaires pour évaluer de façon correcte les performances du CT : les patients n'étaient pas inclus consécutivement, il n'y avait pas de suivi, pas d'arrêt de l'anticoagulation sur la base d'un CT normal. C'est pourquoi, les auteurs insistent sur la nécessité de pratiquer d'autres études prospectives avec des patients consécutifs afin de pouvoir déterminer la sensibilité, la spécificité de l'examen et sa place dans une démarche diagnostique. Depuis ces revues, Goodman et coll. ont publié un travail portant sur le suivi à trois mois de patients non anticoagulés sur la base d'un CT normal (53). Le suivi après un CT normal ne montre pas plus de décès ou de récidive qu'après une angiographie pulmonaire normale. Une autre étude (54), utilisant l'algorithme de prise en charge validé prospectivement par Perrier et coll. (29) pour poser ou exclure le diagnostic d'EP, imposait, en plus, un CT-Scan aux patients inclus. L'examen était lu par trois radiologues trois mois plus tard de façon indépendante sans connaître l'histoire clinique du patient. Les résultats de ce travail ont permis de déterminer la sensibilité et la spécificité de cet examen par rapport à la scintigraphie et à l'angiographie : la sensibilité est de 70% et la spécificité de 91%. Un très petit nombre d'examens s'avèrent non conclusifs (4% des examens) en raison de problèmes liés à l'acquisition des images. Cet examen n'a pas des performances suffisantes pour être utilisé seul pour poser ou exclure le diagnostic d'EP selon les auteurs de l'étude. Par contre, il peut être aisément inclus dans une stratégie diagnostique après un ultrason veineux des membres inférieurs et une scintigraphie pulmonaire : le risque de faux négatifs (EP non diagnostiquée et non traitée) s'amenuise pour n'être plus que de 5%. Dans ce genre de prise en charge une angiographie pulmonaire ne serait plus nécessaire et serait remplacée par le CT-spiralé.
3. Place de la clinique
3.1. La probabilité clinique d'EP
Depuis longtemps, la clinique de l'embolie pulmonaire est considérée comme non fiable puisque la prévalence de la maladie lorsqu'on la suspecte cliniquement chez un patient ne dépasse pas 35% dans les études. Dans les centres qui pratiquent des études successives sur la maladie thromboembolique, elle est actuellement encore plus basse, autour des 20%. Le problème majeur est donc de pouvoir identifier les patients chez qui le diagnostic sera posé ou, à l'opposé, d'identifier ceux chez qui il sera exclu. Actuellement ceci ne peut se faire que grâce aux examens radiologiques complémentaires.
Pourtant l'appréciation de la présentation clinique et des antécédents des patients est importante. En effet, l'intégration des antécédents, des facteurs de risque, des signes et symptômes du patient permettent une prédiction relativement correcte du risque d'avoir ou pas une EP : c'est la notion de « probabilité clinique » d'EP. Cette notion peut être définie comme la « prévalence de l'EP rapportée à un seul individu » (55) car elle permet d'identifier des sous-groupes de patients chez qui la prévalence de l'EP est beaucoup plus faible ou plus élevée en fonction de l'anamnèse et de l'examen clinique.
L'étude PIOPED (36) a montré que la probabilité clinique d'EP, basée sur l'évaluation à priori des facteurs de risque, les symptômes et signes cliniques ainsi que sur l'ECG, la gazométrie et la radiographie de thorax, est assez bien corrélée avec la prévalence de l'EP vérifiée par l'angiographie. Cette constatation permet même d'éviter le recours à un examen invasif de confirmation en combinant le résultat de la scintigraphie et l'établissement de la probabilité clinique pour poser un diagnostic. En effet, la probabilité d'une maladie après un test donné ne dépend pas que des caractéristiques du test en termes de sensibilité et spécificité mais aussi de la probabilité de maladie avant le test, selon le théorème de Bayes (56). C'est ainsi que, pour un même résultat de scintigraphie pulmonaire, la prévalence d'EP sera différente selon la probabilité clinique d'EP (Figure 4).
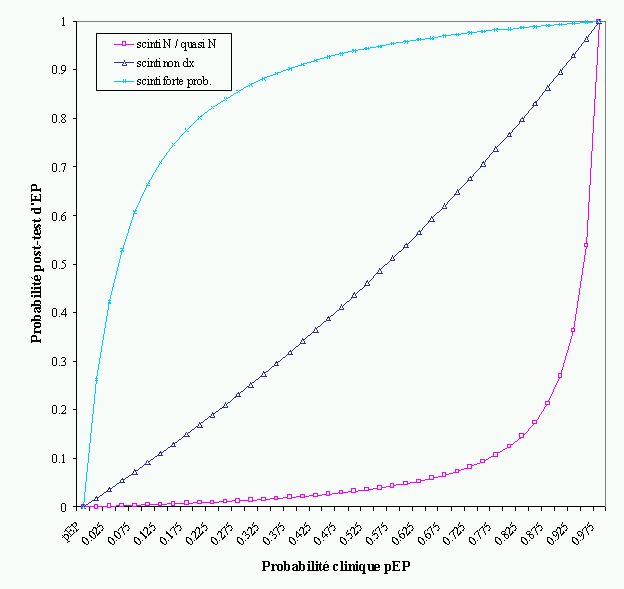
L'étude PIOPED a confirmé ces données théoriques en montrant qu'une probabilité clinique faible d'EP et une scintigraphie de faible probabilité s'associent à une faible prévalence d'EP dans ce collectif (4%), tandis qu'une scintigraphie de forte probabilité et une probabilité clinique forte s'associent à une prévalence élevée d'EP (96%). Il serait donc possible et suffisamment sûr pour le patient d'exclure le diagnostic d'EP sur la base d'une probabilité clinique faible et d'une scintigraphie de faible probabilité.
L'évaluation de la probabilité clinique fait également partie de l'algorithme validé par Perrier et coll (27-29). L'association d'une scintigraphie de faible probabilité, d'une probabilité clinique faible et d'un ultrason veineux négatif permettent d'éliminer le diagnostic d'EP avec un très faible taux de récidives au suivi, 1,7% (57). Cette combinaison permet d'éviter une angiographie chez environ 20% des patients et s'est avérée favorable pour ce qui est du rapport coût-efficacité pour autant que la prévalence de l'EP dans ce collectif de patients ne dépasse pas 20% (58).
3.1.a Les facteurs de risque d'EP
L'appréciation de la probabilité clinique d'EP repose d'abord sur la présence ou l'absence de facteur de risque pour l'EP. Les études épidémiologiques (18-21,59), ont permis de mettre en évidence des facteurs de risque de maladie thromboembolique. Les facteurs de risque les plus souvent cités sont : la chirurgie récente, la présence d'une néoplasie active, une immobilisation prolongée récente (le facteur de risque le plus fréquent, retrouvé chez 55% des patients), les varices et l'insuffisance veineuse chronique, les traumatismes récents, un accident vasculaire cérébral avec plégie ou parésie séquellaire d'un membre, l'insuffisance cardiaque. On rajoute aussi la grossesse et le post-partum, identifiés comme des facteurs de mortalité maternelle non négligeables dans des registres cités par Hull et coll. (60), et confirmés dans une étude récente (61). La contraception hormonale a été également démontrée comme facteur de risque (62). Une analyse multivariée de l'étude de la Mayo Clinic a retrouvé d'autres facteurs de risque parmi lesquels la pose récente d'une voie veineuse centrale ou d'un pacemaker, les thrombophlébites superficielles. L'étude de Framingham (63) et celle des nurses américaines ont retrouvé l'obésité et le tabagisme comme facteurs de risque (64). La présence d'un ou plusieurs facteurs de risque est capitale dans l'évaluation d'un patient avec une suspicion clinique d'EP comme le confirme, entre autres, Stein et coll. sur les patients de PIOPED : 82% des patients ayant une EP avaient au moins un facteur de risque de MTEV (65).
3.1.b La présentation clinique
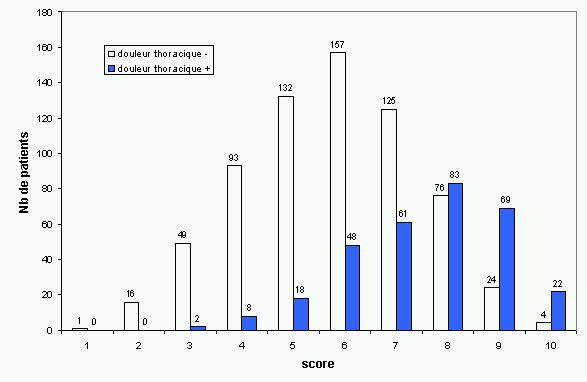
Le mode de présentation clinique a aussi son importance. Les symptômes et signes cliniques qui font évoquer le diagnostic d'EP sont peu spécifiques. Dalen (66) a séparé la présentation clinique de l'EP en trois grands syndromes : l'infarctus pulmonaire qui consiste en la survenue brutale de douleurs thoraciques respiro-dépendantes parfois associées à une dyspnée, la dyspnée isolée, qu'elle soit aiguë ou progressive et la syncope avec hypotension artérielle. Stein et coll. ont évalué la fréquence des divers symptômes, signes et anomalies de l'ECG, de la gazométrie et de la radio de thorax chez les patients de PIOPED (36 ; 65) qui n'ont pas de maladie cardio-pulmonaire préalable, ces patients ayant une plus forte probabilité d'avoir des symptômes attribuables à l'EP et non pas à une de leur comorbidité. Une équipe d'Italie a également étudié la présentation clinique des patients inclus dans l'étude PISA-PED, un tableau (Tableau 1) montre leurs résultats comparatifs (67). Certains symptômes sont fréquents en cas d'EP mais les mêmes symptômes sont également fréquemment présents chez les patients chez qui la maladie a été exclue. Néanmoins, en dépit d'une différence statistiquement significative entre les deux groupes concernant certains symptômes, on ne parvient à mettre en évidence une présentation clinique propre à l'EP.
Stein et coll. ont évalué les caractéristiques cliniques présentes et absentes de ces trois syndromes sur des patients de PIOPED ainsi que leurs corrélations avec la sévérité de l'EP à l'angiographie (68). Il a pu montrer que l'infarctus pulmonaire est la forme la moins sévère et la plus fréquente d'EP (65%), avec une obstruction vasculaire périphérique à l'angiographie. Cette présentation clinique s'accompagne de douleurs thoraciques de type pleurales, et moins souvent de dyspnée, d'hypoxémie, d'anomalie de l'ECG, que les deux autres. En revanche, les anomalies radiologiques sont plus fréquentes. Une forme intermédiaire en fréquence (20%) est la dyspnée isolée qui s'accompagne fréquemment d'une défaillance cardiaque droite, d'hypoxémie et d'anomalie de l'ECG ; sa sévérité en terme d'amputation du lit vasculaire à l'angiographie est également intermédiaire. Enfin, la forme la plus sévère est la syncope qui correspond fréquemment à une EP massive avec une obstruction vasculaire centrale. C'est aussi la forme la plus rare (10%). L'hypotension artérielle est fréquente de même que les anomalies à l'ECG.
On peut déduire de ces travaux que, même s'il existe, en gros, trois modes de présentations cliniques de l'EP, leurs caractéristiques peuvent presque aussi fréquemment se retrouver chez les patients sans EP. Il en va de même pour les facteurs de risque puisqu'on en retrouve au moins un chez 65% des patients suspects d'EP qui n'ont pas la maladie.
Il faudrait pouvoir mieux différencier ces deux groupes de patients soit en ayant de meilleurs moyens d'établir la probabilité clinique, ce serait l'usage de scores standardisés, soit en pouvant mieux identifier les patients sans embolie pulmonaire.
3.1.c Scores cliniques
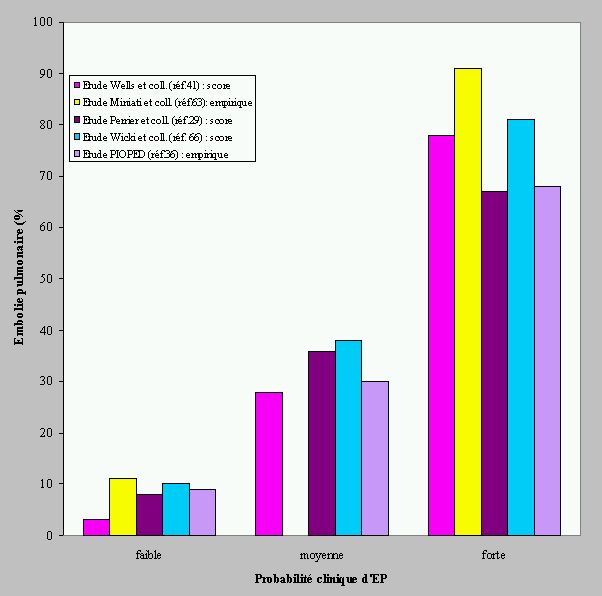
Dans l'étude PIOPED, ainsi que dans les études de Perrier et coll, la probabilité clinique est appréciée de manière empirique (Tableau 2).
On reproche parfois à cette évaluation son manque de reproductibilité et sa subjectivité. Cependant, dans ces deux études, l'évaluation de la probabilité (faible , moyenne ou forte) est assez bien corrélée avec la prévalence de l'EP dans chacun des groupes de patients (Figure 5).
Une façon de remédier à ce problème est de standardiser l'établissement de la probabilité clinique, par exemple par un score. Wells et coll. ont cherché à établir une telle règle de prédiction (41,69-70) . Leur score a été créé par divers spécialistes de médecine en fonction des données de la littérature et de la présentation clinique des patients, puis le modèle a été approuvé par un consensus d'experts. Le score a été établi et validé sur une cohorte de patients ambulatoires et hospitalisés. Les patients étaient classés en trois groupes de symptomatologie : typique d'EP, non typique d'EP et EP sévère, selon la présence ou l'absence de symptômes préétablis, et en tenant compte d'un diagnostic alternatif possible ou non. Les facteurs de risque habituels de la MTEV étaient également pris en compte (Figure 6).
Le score est difficile à apprécier et pas entièrement dépourvu de subjectivité puisqu'il faut tenir compte d'une alternative diagnostique au diagnostic d'EP. Il s'agit en fait d'apprécier si un autre diagnostic que l'EP pourrait être responsable de la symptomatologie du patient et également, si cet autre diagnostic est plus ou moins probable que l'EP pour le patient en question. Par contre, ce score semble bien corrélé avec la prévalence de l'EP dans les trois catégories. Sa reproductibilité semble bonne entre les 5 centres participant à l'étude et lorsque le diagnostic d'EP a été exclu, il y a très peu de récidives (0,6%). Ce score a refait l'objet d'une publication récente de Wells et coll. qui tente de le simplifier en pratiquant une analyse par régression logistique des paramètres pris en compte dans l'établissement du premier score et permet ainsi d'obtenir des points à additionner (69-70). Un dosage des D-dimères par une méthode d'agglutination au latex est rajoutée. La conjonction d'une probabilité clinique faible calculée par le score et un test négatif permettraient d'exclure avec sécurité le diagnostic d'EP. Une validation prospective est cependant nécessaire pour compléter la fiabilité préliminaire du score.
A partir de données rétrospectives, Wicki et coll. (71) ont publié un travail portant sur une règle de prédiction calculée par analyse multivariée. Les paramètres pris en compte pour l'analyse sont les facteurs de risque, les symptômes et signes cliniques ainsi que la gazométrie et la radiographie de thorax. Huit paramètres prédictifs d'embolie pulmonaire ont pu être retenus auxquels on a attribué des points de 0 à 3 selon la valeur du coefficient de régression de chaque paramètre. Le score de 0 à 16 permet de prédire qu'un score inférieur ou égal à quatre est associé à une probabilité faible d'EP dans le collectif rétrospectif. Le score semble également mieux identifier les patients avec forte probabilité d'EP puisque dans ce groupe, la prévalence d'EP approche les 80% contre 68% avec l'évaluation empirique (Figure 5 et Tableau 2). Une validation prospective de ce score est en cours.