[Précédent]
Introduction
Le problème de la sténose urétrale se retrouve dans toute l'histoire de l'humanité. Déjà au temps des Egyptiens, les pharaons se faisaient ensevelir avec des dilatateurs en cuivre au cas où leur sténose urétrale se remanifesterait dans l'au-delà. De même, les écrits laissés par les Grecs ou les Hindous font mention de l'utilisation de différents cathéters pour faciliter le drainage vésical. Les connaissances et les techniques vont ensuite évoluer plus ou moins rapidement au travers des différentes périodes de l'Histoire pour aboutir à celles de la chirurgie moderne où on assiste à un changement radical dans les techniques chirurgicales employées. Il y a d'une part les progrès de la chirurgie ouverte, utilisant le plus souvent des transferts tissulaires et d'autre part, ceux de la chirurgie endoscopique grâce à la miniaturisation de plus en plus performante des divers instruments, parmi lesquels le laser à la place ou en association à l'urétrotomie à la lame froide.
Ce travail vise donc à faire le point sur le traitement des sténoses urétrales par laser, son efficacité, sa sécurité d'utilisation, ses indications et contre-indications, en définitive la place qu'il occupe à ce jour dans l'éventail des traitements disponibles pour aborder cette pathologie de l'urètre.
Dans ce but, j'ai entrepris une étude rétrospective portant sur un collectif de 44 patients présentant une ou plusieurs sténoses de l'urètre traitées par urétrotomie au laser entre la fin de l'année 1994 et le début de l'année 1998 à la clinique d'urologie de l'hôpital cantonal universitaire de Genève.
Les résultats obtenus comportent un triple intérêt :
-
comparer l'expérience genevoise à celle d'autres équipes dans le domaine,
-
comparer les résultats du laser dans l'ensemble par rapport à ceux obtenus au moyen d'autres techniques,
-
définir le champ d'application de cette modalité thérapeutique pour obtenir la meilleure efficacité dans le traitement de la sténose urétrale.
Pour ce faire, après quelques considérations anatomiques et étiologiques sur les sténoses urétrales, on détaillera les différentes techniques chirurgicales existantes, leurs indication principale et efficacité comparative avant de se pencher sur l'utilisation du laser en urologie, l'historique de son développement, son fonctionnement, ses effets sur les tissus vivants, ses risques et effets indésirables. On présentera enfin les résultats de l'étude clinique, en débattra dans la discussion pour conclure enfin.
Historique de la sténose urétrale
Comme la plupart des maladies, celle du rétrécissement de l'urètre a évolué lentement dans sa connaissance. Ce n'est qu'à partir du XVIIIème siècle qu'elle commence à s'individualiser par rapport aux autres affections du canal urétral.
Dans les temps anciens et depuis l'Antiquité, les premiers médecins ne disposaient que d'éléments cliniques pour définir les états pathologiques, confondant largement symptôme, maladie, et mécanisme pathogénique supposé. Ainsi, le rétrécissement urétral, longtemps méconnu, fut tantôt désigné par les troubles qu'il déterminait (strangurie signifiant goutte-à-goutte mictionnel, et ischiurie signifiant rétention), tantôt par le terme de " carnosités ", désignant les causes supposées de l'obstruction urinaire basse. Evoquées au 1er siècle av. J.-C. par Héliodore puis par Galien au 2ème siècle ap. J.-C., elles étaient décrites comme des excroissances charnues ou calleuses, nées de la muqueuse urétrale et d'origine vénérienne. Malgré l'absence de preuve de leur réalité, elles furent encore citées jusqu'à la Renaissance, la médecine de l'époque restant fidèle à l'école gréco-romaine.
Pendant cette période empirique de l'urologie, le traitement des carnosités relevait ''d'artifices pour pisser par médicaments et d'artifices pour pisser par instruments'' (Guy de Chauliac, XIVème siècle). Les médicaments utilisés allaient des bains, onguents, tisanes, lavements opiacés, à l'irritation du méat par un pou ou une punaise en cas de rétention aiguë. Dans les mêmes circonstances, Hippocrate conseillait la saignée pour dissiper la strangurie alors que Paré (chirurgien français, 1510-1590) proposait les frictions de gaïac, la blénorragie et la vérole étant à l'époque souvent confondues. Les instruments, sondes ou bougies, avaient pour but non seulement de dilater le canal rétréci, mais encore, dans certains cas, de détruire directement les hypothétiques carnosités. Les sondes étaient faites de métal, de cuivre, d'or ou d'argent. De calibrage progressif, elles dessinaient une large courbe dans leur moitié antérieure pour mieux s'adapter au profil de l'urètre. La rigidité des cathéters métalliques permettait de forcer l'obstacle urétral et de drainer une vessie rétentionnelle. La première mention d'une urétrotomie interne date à cet égard de l'ouvrage ''Opera chirurgica'' d'Héliodore écrit en 90 ap. J.-C. où l'auteur décrit le traitement des rétrécissements urétraux par une incision ou excision antérograde interne par la lame d'un stilet pointu et tranchant. Parallèlement, pour assurer une meilleure tolérance de sondage, des instruments plus souples en papier séché, en cuir ou en toile enduite de cire furent utilisées par Oribase (médecin grec, IVème siècle ap.J.-C.), Avicenne (médecin iranien, XIème siècle) et Fabrice d'Acqapendente (anatomiste italien, XVème siècle).
Les bougies, également d'origine ancienne, étaient de forme cylindrique, terminés en cône et constituaient des sortes de baguettes de cire filée ou de plomb.
Mais, de façon permanente au long des siècles, et en particulier à la Renaissance, les opérateurs ont tenté la destruction directe des carnosités. Elle était obtenue par des cathéters tranchants ou pointus (Albucasem 1180 ap. J.-C.) ménageant un néocanal à l'aide d'un petit couteau, Ambroise Paré réalisant des urétrotomies internes antérogrades à l'aide de bougies de plomb dont l'extrémité constituait une lime se déplaçant dans le tissu sténotique), ou par l'application de substances caustiques puissantes telles que les sels de mercure, le vitriol ou le vert de gris. Henry IV, souffrant de sténoses urétrales, fut soigné par l'introduction journalière d'une canule d'argent dont l'extrémité propulsait sur la sténose un mélange de poudre de génévrier et de beurre frais.
Au XVIIIème siècle, l'histoire des rétrécissements urétraux connut des modifications essentielles pour le développement de l'anatomie pathologique et des études cadavériques mettant en doute l'existence des carnosités. Ces travaux précisèrent progressivement les caractères anatomo-pathologiques des rétrécissements tels qu'ils sont connus actuellement. Chopart (chirurgien français, 1743-1795). Desault (chirurgien français, 1744-1796), Hunter (chirurgien anglais, 1728-1793) en donnèrent des descriptions détaillées et toujours d'actualité. Ils montrèrent qu'ils constituaient la cause la plus fréquente des troubles mictionnels à côté du ''gonflement prostatique'' nouvellement identifié. Hunter fut d'ailleurs le premier dès 1767 à perforer l'urètre par voie latérale après avoir incisé l'urètre sain dans sa portion post-sténotique et à proposer l'introduction d'un cathéter de façon antérograde après avoir ponctionné dans la région suprapubienne en cas de rétention urinaire aiguë. Bell (chirurgien et anatomiste anglais, 1763-1820) inventa quant à lui la véritable urétrotomie interne rétrograde en mettant au point un instrument ayant à son bout d'exploration une lame émoussée à l'avant et tranchante à l'arrière.
Mais la recherche de matières plus souples, mieux tolérées et moins traumatisantes aboutit à un progrès décisif : Bernard, orfèvre-mécanicien français, se servant du caoutchouc qui venait d'être importé (1845), réalisa des sondes en gomme élastique de consistance jugée idéale et parfaitement lisses.
Associées ou non aux sondes, les bougies devinrent l'élément essentiel de la dilatation et selon J. Hunter : " elles doivent être regardées comme une des découvertes les plus importantes que la chirurgie ait faites au milieu du XVIIIème siècle ". Leur fabrication était souvent réalisée par le chirurgien lui-même et minutieusement décrite dans tous les traités. La dilatation était elle-même l'objet de controverses.
La plupart des auteurs utilisaient des bougies simples faites de linge traité par un emplâtre de diachylon, de cire et d'huile d'olive. Ils préconisaient des dilatations progressives et graduelles, guidées par les réactions du patient et selon une technique rigoureuse, le traitement pouvant s'étaler sur 3 à 4 semaines.
D'autres, pour obtenir une guérison rapide, s'efforçaient de franchir la sténose par une forte pression, au risque d'établir une fausse route dont certains reconnurent même l'utilité, puisqu'elle rétablissait l'évacuation vésicale.
A la même époque, les drogues d'autrefois, moins utilisées, conservaient une place dans les cas difficiles, par exemple le nitrate d'argent dans l'école anglaise sous l'influence de Hunter. En revanche, les bougies dites " médicamenteuses " connurent un grand succès avec Daran et d'Alliès. Leur composition, très souvent tenue secrète, aurait eu des vertus fondantes et suppuratives auxquelles on attribuait l'action de la dilatation ; cette interprétation fut combattue à la fin du siècle pour ne retenir que le rôle de la compression mécanique exercée par les bougies.
Il semble toutefois que ces cathétérismes se heurtaient souvent à de sérieuses difficultés dues à la complexité des lésions aggravées par les retards diagnostiques, les complications infectieuses et les fistules. Les opérateurs avaient alors recours, mais avec de fortes réticences, à la ponction au trocart ou au travers d'une incision pour le drainage vésical. Curieusement, la plupart préféraient la voie périnéale inspirée de la taille classique. La voie hypogastrique était jugée trop dangereuse à cause des blessures possibles du cul-de-sac péritonéal et de la contamination septique du tissu cellulaire pelvien.
Le XIXème siècle profita des nouvelles connaissances scientifiques et techniques appliquées à la chirurgie en général et à l'urologie en particulier. Les problèmes urétraux continuèrent d'accaparer l'activité de nombreux chirurgiens mais l'apparition des connaissances nécessaires au travail du caoutchouc, de l'acier, le découverte de l'énergie électrique amenèrent à une accélération du développement de l'instrumentation ; successivement dans la première moitié du XIXème siècle, des bougies en gomme à bout olivaire, des sondes bicoudées à bout rond, des sondes autostatiques à ballonnet gonflable et des sondes droites et souples en caoutchouc vulcanisé firent leur apparition. Leroy d'Etiolles (1798-1869) inventa les bougies filiformes tortillées qui permettaient de franchir les sténoses serrées ou excentrées ; Béniqué (1806-1831) construisit les bougies coudées à bout mousse, graduées au sixième de millimètre et qui allaient porter son nom. Maisonneuve (1809-1894) imagina en 1845 le " cathétérisme à la suite " par sonde vissée sur une bougie filiforme et mit au point une ingénieuse technique d'urétrotomie interne dont la technique prévalut sur l'urétrotomie externe de Syme et Sédillot : premièrement, il introduisait une bougie élastique fine dans la vessie ; puis un explorateur métallique était vissé à l'extrémité de la bougie, pouvant être poussé en avant dans l'urètre pendant que la partie élastique s'enroulait dans la vessie. Ainsi la sténose pouvait être incisée avec une lame triangulaire le long du canal. Désormeaux (1815-1882) se consacra à l'étude de l'endoscopie, intervint sur les lésions urétrales par ce biais et publia son " Traité de l'Endoscopie " en 1865. Sa méthode avait deux désavantages : une mauvaise source de lumière et un système optique déficient.
Ces interventions à l'aveugle restèrent une grande partie du traitement des sténoses post-gonorrhée. De nombreux urétrotomes firent leur apparition mais les plus sûrs et les plus employés dans la seconde partie du siècle furent ceux de Stafford et Ivanich pour la technique rétrograde et celui de Maisonneuve pour l'antérograde.
Lentement, une nouvelle méthode fit son apparition et fut proposée formellement par Perrève en 1847 : il s'agissait de la lacération violente et de la dilatation soudaine de la sténose au-dessus de son diamètre normal. La narcose au chloroforme récemment introduite poussait cette technique à supplanter l'urétrotomie interne. La dilatation atteint son apogée à la fin du XIXème siècle avec les instruments de Kollmann (Leipzig) et Otis (New York). Ce dernier recommandait la combinaison de la méatotomie et de l'urétrotomie interne avec son " urétrotome dilatateur " dans les cas de sténoses multiples.
Les complications de l'urétrotomie interne telles que la mort subite par choc, néphrite aiguë, abcès posthémorragique, pyémie, orchite et perforation rectale forcèrent les chirurgiens à chercher d'autres possibilités de traitement. L'électrolyse fut introduite après 1870, essentiellement par Newman à New York. Le principal désavantage était la longueur du traitement, 3 à 4 mois, et l'effet minime sur les sténoses charnues qui ne pouvaient pas non plus être traitées par dilatation.
D'autres techniques furent proposées : le ramollissement de la sténose par une solution de thiosamine (1891), un appareil semblable à un inciseur de prostate (Lohnstein, Berlin, 1900) qui incisait la sténose par un couteau électrique triangulaire fait de platine et d'iridium. En 1905, Seelhorst (Pays-Bas) modifia l'électrolyse en introduisant l'aiguille à travers l'urétroscope dans le canal rétréci mais des abcès et des fistules en furent souvent la conséquence.
De nombreuses améliorations furent apportées aux urétrotomes par la suite. Powell (Londres) publia une nouvelle version où un instrument (couteau, curette) pouvait être actionné vers l'avant depuis la paroi de l'urétrotome. Il s'agissait donc d'un prolongement du tube opératoire avancé précautionneusement en même temps. L'opération avait lieu sous vue dans un urètre gonflé à l'air.
Dans les années trente, les urologues allemands préconisèrent la perforation énergique avec l'instrument de Maisonneuve. Dans le cas d'une réaction locale importante ou d'une hémorragie, il fallait mettre en place un cathéter permanent. Les sténoses très serrées devaient être perforées par un trocart suprapubien.
Un progrès essentiel pour l'urétrotomie interne fut l'arrivée de l'urétroscope de Fischer (Heynemann, Allemagne, 1937) qui rendait possible l'électrocoagulation à vue pour les sténoses courtes, multiples et profondes mais moins pour les sténoses longues et superficielles. Le traitement se modifia encore avec la mise au point des bougies seulement légèrement courbées par Düttmann en 1938 puis en 1948 où May (Münich) commença le calibrage droit.
De tous les urétrotomes inventés depuis 1830, seuls les urétrotomes antérogrades de Maisonneuve et dilatateurs d'Otis restent d'actualité.
Etiologie des sténoses urétrales
L'étiologie des sténoses urétrales ne revêt pas seulement un intérêt académique mais détermine le type de sténose rencontré et, dans certaines situations, le mode de traitement approprié. L'épithélium urétral est extrêmement fin et s'appuie sur la plus grande partie de sa longueur sur le tissu spongieux sous-jacent. Dans la partie membraneuse de l'urètre, la muqueuse repose sur la musculature du sphincter urétral externe. En conséquence, tout événement endommageant l'épithélium expose un tissu spongieux par lequel une infection ou une exposition à l'urine peut entraîner un phénomène de spongiofibrose. (cf figure 0) L'éventuelle sténose consécutive peut être due soit aux processus de réparation à l'endroit de la dénudation urétrale soit aux phénomènes cicatrisants au niveau du tissu spongieux atteint. La spongiofibrose peut ainsi s'étendre loin à distance du site de la lésion et, particulièrement en amont, être simplement recouverte de tissu urétral normal. L'épaississement et la perte d'élasticité de la muqueuse en amont du site lésionnel de même que la spongiofibrose sous-jacente sont très probablement dues à l'extravasation de l'urine due à l'hyperpression urinaire en amont du rétrécissement.
La difficulté à apprécier la véritable longueur de l'atteinte sténotique peut s'avérer être une des raisons de l'échec du traitement chirurgical. C'est pour cette raison qu'il est recommandé d'aborder chirurgicalement non seulement le site rétréci, mais également de réséquer la partie spongiofibrotique de l'urètre en étendant de 1 à 2 cm les limites de résection ou d'incision.
Etiologie congénitale
Elle est probablement relativement rare. Des études embryologiques cherchant à expliquer la localisation sténotique à la jonction bulbomembraneuse suggèrent que l'ébauche urétrale épidermique distale ne rejoindrait pas totalement l'ébauche prostatique endodermique distalement par rapport à la jonction bulbomembraneuse, une sténose représentant alors une rupture incomplète de la membrane cloacale.
Pourtant, le nombre de sténoses attribuées à une cause congénitale est probablement exagéré, le manque de certitudes pour une origine traumatique ou infectieuse amenant souvent à une l'attribution d'une origine congénitale.(Blandy J.P., Saunders, 1977 ; Cobbs B.G., J Urol, 1968)
Il a été démontré que leur paroi était constituée de muscle lisse et pas de tissu fibro-collagéneux, que l'on aurait pu attendre dans le cadre d'une origine infectieuse ou traumatique. Ces sténoses, décrites comme molles et diaphaneuses, répondent normalement bien à un traitement endoscopique délicat.
Etiologie infectieuse
Les sténoses inflammatoires sont le plus souvent associées à la gonorrhée et aux urétrites non spécifiques, le plus souvent dues aux chlamydias. Des infections uniques, traitées de manière adéquate et rapidement ne devraient pas endommager l'épithélium et guérir rapidement. Au contraire, des épisodes infectieux répétés ou mal traités amènent à des processus inflammatoires locaux sévères conduisant à une cicatrisation. Au contraire des sténoses traumatiques, qui sont le plus souvent courtes et discrètes, les sténoses inflammatoires impliquent une partie importante de l'épithélium urétral et du tissu spongieux sous-jacent, ce qui a une importance fondamentale pour le traitement. C'est précisément le degré d'atteinte du tissu spongieux sous-jacent qui va conditionner le déroulement naturel de la maladie et la réponse au traitement. Les atteintes muqueuses superficielles vont engendrer des sténoses qui résultent probablement de la cicatrisation croisée des bords de muqueuse atteinte, cicatrice molle et diaphaneuse qui se laisse facilement lever par des calibrages itératifs avec un faible taux de rechute. Si l'infection a provoqué une fibrose profonde et étendue du tissu spongieux, la sténose provient de la contraction de la cicatrice et l'urétroplastie se révèle alors nécessaire. Une ancienne sténose superficielle peut se transformer en sténose épaisse après des manoeuvres traumatiques entraînant infection ou extravasation urinaire affectant alors le tissu spongieux. (Hermida Perez J.A., Archives Espanoles de urologica, 1997 ; Mc Millan A., Genitourinary Medicine, 1994)
Les processus inflammatoires chroniques sont rares, des rétrécissements consécutifs à une tuberculose ou un schistosomiase étant rapportés.
Etiologie ischémique
Des sténoses urétrales consécutives à une chirurgie cardio-vasculaire, en particulier à la suite de l'utilisation de la circulation extra-corporelle, ont été rapportées jusque dans 22% des cas. Les mécanismes invoqués comprennent le cathéter utilisé, la durée du cathétérisme mais la cause primaire semble pourtant bien être l'ischémie (Elhilali M., J Urol, 1986). Ces rétrécissements surviennent typiquement dans l'urètre pénien et ont différentes longueur et sévérité. L'utilisation de cathéters suspubiens ou de cathéters urétraux siliconés de petit calibre sont susceptibles de réduire le risque de ces complications. (Buchholz N., J Urol, 1993 ; Katz G., Urology, 1992).
Etiologie traumatique
Il s'agit des causes les plus fréquentes des sténoses urétrales, comprenant par ordre de fréquence décroissante les atteintes iatrogéniques résultant d'instrumentation urétrale, les conséquences urétrales des fractures pelviennes, les blessures périnéales franches et les lésions à l'arme blanche ou aux armes à feu, (Chapple C.R., Current Opinion in Urology, 1999).
Lésions urétrales iatrogéniques
Elles sont les plus fréquentes, les sondages malhabiles étant le plus souvent responsables . La chirurgie endoscopique transurétrale (résection endoscopique de prostate, vessie), malgré toutes les précautions requises, est malheureusement parfois en cause. Le méat urétral et l'urètre bulbaire sont les sites les plus touchés. (Mosbah A., Acta Urologica Belgica, 1990 ; Acunas B., Eur J Urol, 1988)
Lésions urétrales consécutives à des fractures pelviennes
La plupart sont dues à des accidents de la circulation mais se retrouvent également chez les mineurs, bûcherons, travailleurs de la construction ou manipulant du matériel lourd. L'urètre membrano-prostatique est lésé dans environ 10% des cas de fracture pelvienne et l'amplitude de l'atteinte détermine l'extension de la dislocation vésico-urétrale. Le spectre des lésions va de la simple contusion aux sections complètes de l'urètre. Le degré d'atteinte détermine le traitement et le pronostic. Les élongations urétrales se traitent par mise en place d'une sonde et guérissent généralement sans sténose résiduelle. Les déchirures partielles ont un potentiel de guérison asténotique en l'absence d'instrumentation ou d'infection. Les ruptures complètes, pouvant atteindre jusqu'à 5 cm de longueur, aboutissent à une oblitération urétrale. Elles réclament en général, en raison de l'état du patient, une cystostomie initiale dans la phase aiguë.
Certaines fractures pelviennes atteignant l'urètre vont causer des atteintes vasculaires et neurologiques amenant ensuite à l'impuissance. Certains auteurs (Crassweller P.O., J Urol, 1977 ; Mark, S.D., Br J Urol, 1995) ont montré que la fracture des deux branches pubiennes est la plus susceptible d'endommager les structures neurovasculaires des deux côtés et d'entraîner de ce fait un impuissance. Même si un grand nombre de cas d'impuissance est dû à la blessure elle-même, une lésion des éléments vasculo-nerveux lors d'une intervention chirurgicale n'est jamais à exclure.
Lésions périnéales franches
La plupart des blessures périnéales sont dues à des phénomènes d'enfourchement, l'urètre se trouvant coincé et comprimé contre la symphyse sus-jacente. Les blessures pénétrantes sont plus rares, mais sont devenues plus fréquentes avec l'évolution de la société. La faible vitesse des projectiles d'arme de poing aboutit à des lésions localisées au contraire des armes militaires qui causent des dégâts à distance considérables. L'énergie du processus traumatique détermine l'extension des lésions, une déchirure partielle la plus fréquente pouvant également être totale dans certains cas. Des ruptures de fascia peuvent amener des hématomes périnéaux ou scrotaux, typiquement en aile de papillon. Si les fascias restent intacts, on assistera plutôt à des phénomènes oedémateux.
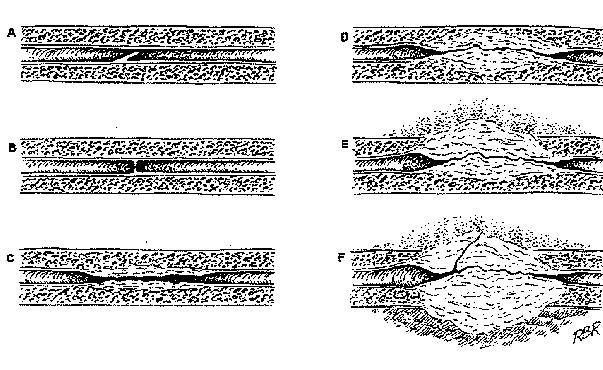 Fig. 0 : L'anatomie des sténoses
(tiré de Blandy & Folwer's urology, 2nd edition, 1996, page 2986)
Fig. 0 : L'anatomie des sténoses
(tiré de Blandy & Folwer's urology, 2nd edition, 1996, page 2986)
|
A: section muqueuse
B: constriction irienne
C: atteinte de toute la muqueuse avec inflammation modérée du tissu spongieux
D: spongiofibrose de toute la couche muqueuse
E: inflammation et fibrose des tissus en dehors de la muqueuse
F: sténose complexe compliquée d'une fistule
|
Pathogenèse des sténoses urétrales
La pathogénèse des sténoses urétrales a été très mal comprise jusqu'aux travaux de Singh et Blandy en 1976 (Singh, M., Blandy, J.P., J Urol, 1976) qui permirent de franchir un pas décisif dans la compréhension du mécanisme amenant à la formation d'un rétrécissement urétral.
Anatomiquement, l'épithélium urétral est extrêmement fin et repose, pour la majorité de la longueur urétrale, sur le tissu spongieux sous-jacent. Dans la partie membraneuse de l'urètre par contre, la muqueuse s'appuie sur la musculature du sphincter urétral intrinsèque. De plus, l'urètre est entouré de glandes paraurétrales surtout dans la portion bulbaire, plus faiblement dans la partie méatale.
Dès lors, deux mécanismes distincts peuvent aboutir à une même conséquence: l'atteinte du tissu spongieux sous-jacent. (Walsh, P.C., Campbell's Urol, 1995)
-
Un phénomène traumatique, par atteinte de l'épithélium urétral et rupture consécutive de sa continuité, aboutit en tout cas à l'exposition à l'urine du tissu spongieux sous-jacent mais le plus souvent à une atteinte concomitante de celui-ci par l'énergie du traumatisme.
-
Un processus infectieux touchant l'urètre s'étend aux glandes paraurétrales avant de déborder dans le tissu spongieux voisin.
Celui-ci est alors le siège de modifications cicatricielles et fibrosantes telles qu'elles se déroulent dans tout tissu lésé.
Quelle que soit la technique que l'on choisira pour aborder l'urètre, il faut toujours penser au processus de cicatrisation qui permet la réparation véritable après l'intervention. Il est clair que ce processus, par son mécanisme et son résultat, amène, comme nous le verrons, au développement de sténoses urétrales s'il est de grande ampleur. Par conséquent, il doit être le plus limité possible pour que le traitement ne soit pas lui-même la cause de la pathologie qu'il visait à résoudre.
Pour bien comprendre l'effet du laser sur le processus de cicatrisation, il faut rappeler les différentes phases de ce processus réparateur. (Hoebeke, P., Ann Urol, 1993)
Phase d'inflammation
Elle commence par l'hémostase, la vasoconstriction du vaisseau sectionné, l'agrégation plaquettaire et la formation du caillot fibrino-plaquettaire qui favorise la migration de cellules vers la région atteinte. Une réaction inflammatoire intense avec hyperémie, exsudation de plasma et de protéines chimiotactiques, infiltration par des granulocytes et des monocytes neutrophiles, se produit dans une deuxième phase. Dans un dernier temps, le macrophage, cellule dérivée du monocyte, joue un rôle primordial par sa production de nombreuses substances biologiques actives (facteurs de croissance, facteurs chimiotactiques, protéases, collagénases, prostaglandines et radicaux libres) qui concourent à l'évacuation du bouchon provisoire et à la constitution du tissu de remplacement définitif. Il permet ainsi le passage à la phase suivante, la granulation.
Phase de granulation
Celle-ci se déroule par l'accumulation de macrophages, de fibroblastes et la formation de néocapillaires dans une matrice oedémateuse constituée de fibrine, de collagène et d'acide hyaluronique. Le fibroblaste devient un myofibroblaste, à savoir une cellule dotée de propriétés contractiles qui entraîne la contraction de la plaie.
La néoformation capillaire s'effectue par la pénétration de petits cordons de cellules endothéliales guidées par la fibrine.
La migration de cellules épithéliales se fait basales se déroule dès les premières heures après la blessure à partir des berges de la plaie, passant par une matrice provisoire de fibrine et de collagène. La membrane est formée à la suite de la réépithélialisation. Le recouvrement du tissu granulaire par cet épithélium et par la membrane basale clôt la réaction de granulation.
Il s'agit donc bien de la présence dans la cicatrice de myofibroblastes qui, par leur contraction assurant le rapprochement des berges de la plaie, causent la rétraction voire l'obstruction complète de la lumière urétrale. (Gabbiani, G., Kidney Int, 1992) Ce raccourcissement cicatriciel sera peu prononcé si seul l'épithélium urétral est atteint et nettement plus marqué si le tissu spongieux est également concerné. L'apparition de fibres de collagène dans la matrice cicatricielle concourt aussi largement à l'hypertrophie concentrique du segment lésé, à la fibrose du tissu spongieux ou spongiofibrose et à la formation du rétrécissement cicatriciel qui s'ensuit. Cette spongiofibrose peut largement s'étendre de chaque côté de la portion urétrale atteinte, même sous un épithélium de surface d'aspect normal, ce qui peut rendre aléatoire l'estimation de l'extension du processus cicatriciel et fibrosant. (Raghow, R., FASEB J, 1994)
Phase de formation et de transformation de la matrice
Cette phase dure plusieurs mois après la réépithélialisation. La densité du collagène augmente fortement, les fibres se disposent parallèlement à l'axe de la plaie, provoquant le rapprochement des bords de plaie et accentuant la cicatrice. Ce processus se termine par la formation d'un tissu peu vascularisé.
La durée de la cicatrisation dépend de la superficie de la plaie, une forme ovale et allongée donnant lieu à une cicatrisation plus rapide qu'une forme circulaire.
La cicatrisation plus lente à la suite d'une chirurgie à la lame froide ou au bistouri électrique est due à la réaction inflammatoire persistante provoquée par la nécrose des tissus en profondeur de la plaie.
La rétraction cicatricielle est inhérente au processus de cicatrisation. Elle dépend de la profondeur de la plaie : les plaies superficielles ne se rétractent pratiquement pas au contraire des plaies profondes qui peuvent perdre jusqu'à 50 % de leur longueur. L'inverse est vrai en ce qui concerne la rétraction des greffes : plus un tissu greffé est épais, moins il se rétractera. Le risque de rétraction d'une plaie sera d'autre part d'autant plus élevé que les phases d'inflammation et de granulation auront été longues.
Le traitement des sténoses urétrales
Prise en charge
Les sténoses urétrales sont traitées par une variété de techniques comprenant la dilatation urétrale, l'urétrotomie, la mise en place de stent urétral et un éventail de traitements chirurgicaux. Les moyens les plus utilisés restent cependant la dilatation et l'urétrotomie. Lorsque ceux-ci échouent, le traitement chirurgical à ciel ouvert, qui a pris davantage d'importance ces dernières années, reste la seule solution durable.
Aucune technique ne saurait être appliquée à toutes les sténoses, le choix du traitement se faisant sur la base de plusieurs éléments : la localisation de la sténose, son étiologie, sa longueur, son caractère unique ou multiple, sa localisation par rapport à la région sphinctérienne, la présence ou l'absence de fistules, de nouvelles lumières ou de diverticules.
La spongiofibrose ou fibrose du tissu spongieux sous-tend toutes les sténoses de l'urètre bulbaire et pénien, son degré d'extension vertical et horizontal dictant
pour une large part le choix du traitement. (Blandy et Fowler, Urology, 2nd Edition, 1996; Jorda, Campbell's Urology, 7th Edition, 1998)
Dans la forme la plus bénigne de sténose urétrale, une déépithélialisation d'un petit segment de la lumière urétrale à la suite d'un traumatisme par cathéterisme ou par inflammation ne produit qu'une fibrose minime du tissu spongieux sous-jacent. Dans ce cas, une simple urétrotomie ou une dilatation de la muqueuse cicatricielle suffit à apporter une rémission à long terme. (de Sy W.A., Ann Urol, 1993 ; Hoebeke P., Ann Urol, 1993).
Si la spongiofibrose s'étend à toute la circonférence du tissu spongieux, les techniques précédemment citées ne suffiront pas et une excision-réanastomose ou une réparation par substitution seront nécessaires selon l'extension du processus fibrosant. Même si l'urétrographie rétrograde, l'échographie ou l'endoscopie peuvent apporter quelques renseignements sur l'importance de la fibrose, ce n'est parfois qu'à l'ouverture de l'urètre lors d'une urétrotomie optique ou lors d'une chirurgie que l'on peut véritablement s'en rendre compte objectivement. Il est fondamental à ce propos que la réparation chirurgicale se prolonge au-delà de l'urètre sténotique en territoire sain pour obtenir un bon résultat à long terme. (Campbell's urology, 7th Edition, 1998)
L'importance de la localisation du rétrécissement urétral ne doit pas être exagérée. L'urètre étant divisé en 4 segments aux fonctions propres, l'urètre prostatique, membraneux, bulbaire et pénien, chaque site sténotique comporte des risques particuliers lors du processus thérapeutique. Les sténoses du méat peuvent, après traitement, entraîner des dysmorphies ou des déviations du jet urinaire si le gland n'est pas reconfiguré correctement. Les rétrécissements de l'urètre pénien peuvent également être suivis de problèmes esthétiques ou plus gravement de cordée pénienne. L'urètre bulbaire peut être abordé par le plus grand choix de techniques, l'abondance du tissu spongieux facilitant l'urétrotomie ou la pratique de greffes et diminuant le risque de cordée, les dysfonctions érectiles restant possibles dans le traitement des sténoses bulbaires. Dans l'approche des sténoses membraneuses, le problème de la continence doit être pris en considération car les principes de réparation vont forcément altérer le sphincter distal, la continence ne reposant alors plus que sur le col vésical. (Iselin C.E., J Urol, 1999).
Principes de traitement
Les procédures opératoires actuelles pour l'abord des sténoses urétrales peuvent être classées selon deux principes de base : les procédures d'excision et anastomose, et d'urétroplastie de substitution. Dans certains cas, ces principes peuvent se combiner et se dérouler en une ou plusieurs phases. Historiquement, on s'est appuyé sur un troisième principe : celui de la régénération épithélioïde, qui s'est avéré inefficace.
1) Réparations anastomotiques
Ce sont les techniques les plus efficaces et sont utilisées essentiellement dans le cas de rétrécissements courts de l'urètre bulbaire ou membraneux. Pour être couronnée de succès à long terme, la réparation doit comporter une excision complète de la sténose sur toute sa circonférence ainsi que l'anastomose par chevauchement des deux extrémités saines. Le risque de raccourcissement urétral entraînant potentiellement une cordée ou une diminution de longueur pénienne contre-indique l'application de cette technique dans l'approche des sténoses de plus d'un cm de longueur. Au contraire, les procédures anastomotiques sont applicables aux pertes de substance sur fractures pelviennes à cause de l'extensibilité de l'urètre bulbaire et des nombreuses manoeuvres chirurgicales susceptibles de diminuer les tensions de l'anastomose.(cf. figure 1) (Webster G.D., J Urol, 1991; Webster G.D., J Urol, 1985; de Stefani, Archivio Italiano de Urologica, 1999).
 Fig. 1 : Urétroplastie par résection-anastomose
(Webster, G.D.: Problems in Urology, 1987)
Fig. 1 : Urétroplastie par résection-anastomose
(Webster, G.D.: Problems in Urology, 1987)
2) L'urétroplastie de substitution
Le tissu employé est soit libre (greffe, figure 2), soit pédiculé (lambeau, figure 3) sur sa vascularisation mais il n'existe pas actuellement de substitut idéal à l'urètre: les différentes tentatives d'utilisation de peau pénienne et/ou préputiale, de muqueuse buccale ou vésicale se sont avérées utiles, la récidive ne pouvant être exclue à long terme. (Mundy A.R., Br J Urol, 1995, Mundy A.R., Reconstructive Urol, 1993) En 1993, Turner-Warwick (Turner-Warwick R., Reconstructive urol, 1993) décrivit une technique consistant en l'utilisation d'une bande urétrale plate et fixée abritant sur le restant de la lumière urétrale une couche superficielle substitutive, ramenant ainsi la part de la lumière urétrale substituée à environ 50% et évitant plus efficacement les phénomènes sténotiques. Le substitut urétral idéal serait une surface épithéliale accoutumée à l'humidité, telle que l'épiderme semi- humide (peau prépuciale et/ou pénienne, muqueuse buccale) . Cette dernière rencontre actuellement un enthousiasme important, étayé par des travaux scientifiques de valeur.
(Filipas D., BJU International, 1995 ; Fichtmer J., J Urol, 1998). Les surfaces épithéliales sèches exposées à l'humidité développent en effet des modifications eczémateuses qui concourent à la récidive de la sténose.
Lambeaux ou greffes
Les greffes de peau totale ou de muqueuse buccale ont un taux de succès important lorsqu'elles sont utilisées pour le traitement de sténoses urétrales bulbaires étendues, surtout si elles sont soutenues par un tissu offrant un lit vasculaire adéquat (Boccon-Gibod L., Eur Urol, 1984 ; Osegbe D.N., Eur urol, 1990 ; Mc Aninch J. W., J Urol, 1993). Il a récemment été démontré que les corps caverneux pouvaient être un excellent support à la greffe, possiblement meilleur que le spongieux. (Barbagli G., J Urol, 1998, Iselin C.E., World J Urol, 1998) Ce nouveau principe devra toutefois être validé à long terme (au-delà de 5 ans).Pourtant, plus les greffes sont longues, plus important est le taux d'échec. A noter que le placement dorsal de la greffe a actuellement fait quasi totalement disparaître l'emploi de lambeaux pour les sténoses de l'urètre proximal. Ces derniers sont par contre souvent utilisés lors de la reconstruction de l'urètre pénien. (lambeau transverse de peau pénienne selon Orlandi).
Dans la préparation d'une greffe, il est important d'ôter le tissu sous-épithélial pour faciliter l'ancrage des bourgeons vascularisés. Il faut également avoir à l'esprit que la greffe tend à se réduire de 20% environ et que le tuteur urétral ne doit être enlevé ni trop tôt (risque pour le greffon au contact de l'urine) ni trop tard (risque d'infection).
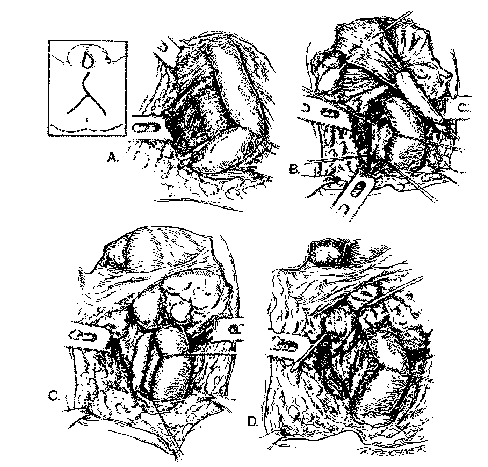
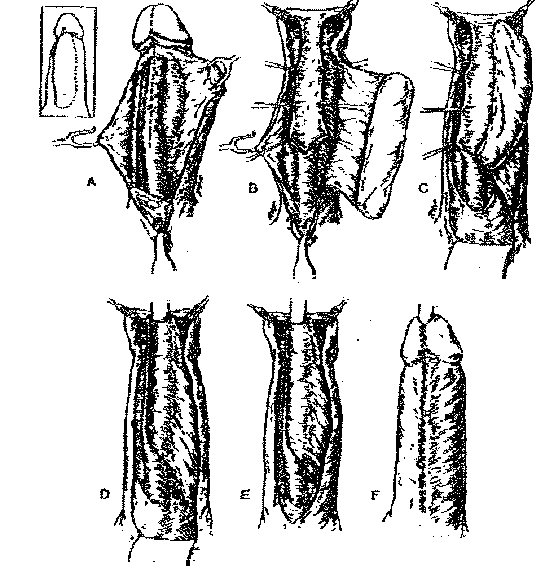 Fig. 2 et 3 : Urétroplastie par lambeau pédiculé
(Webster, G.D.: Problems in Urology, 1987)
Fig. 2 et 3 : Urétroplastie par lambeau pédiculé
(Webster, G.D.: Problems in Urology, 1987)
Traitement non-chirurgical des sténoses urétrales
Dilatation urétrale
Bien que la plupart des sténoses urétrales puissent être dilatées, certaines contre-indications claires existent : les sténoses qui exigent un calibrage dont la fréquence interfère avec la qualité de vie du patient devraient être abordées par une autre méthode car leur réapparition rapide est due à une spongiofibrose importante. La dilatation de sténoses multiples ou longues s'avère souvent difficile et le risque de fausse lumière ou de cicatrice confluente est réel. Les sténoses oblitératives, associées à de fausses lumières, à des phlegmons périurétraux, à des fistules urétrales ou à des calculs urétraux ne sont pas à traiter avec cette technique. (Blandy & Fowler's urology, 1996; Walsh, P.C, Campbell's Urology, 1995)
Les complications de la dilatation sont l'hémorragie et la bactériémie. Cette dernière fait généralement suite à une infection urinaire mais peut se développer sans elle.
Malgré ces nombreuses contre-indications, un certain nombre de sténoses peuvent être traitées avec succès par calibrage occasionnel. Un travail d'Afrique du sud, comparant la dilatation et l'urétrotomie interne par une étude prospective randomisée concernant 210 patients, met en évidence un taux de succès comparable mais un avantage pour la dilatation dans les sténoses longues (>2 cm), post-traumatiques ou sans traitement préalable (Steakamp, J., South Afr J of Urol, 1997).
Pour s'assurer de la pertinence de cette méthode thérapeutique, une urétrographie rétrograde ou une endoscopie doit toujours être réalisée afin de préciser la longueur du rétrécissement. Différents instruments courbés, filiformes et différents matériaux (acier, plastique, gomme élastique, cire) peuvent être employés à cet effet. Le processus de dilatation devrait toujours être progressif, un passage en force entraînant invariablement une atteinte muqueuse ou spongieuse facilitant une extravasation urinaire, prélude à une infection et à une nouvelle fibrose. Ainsi, des sondes en acier ou des sondes filiformes sont utilisées pour dilater la sténose jusqu'à ce qu'elle présente une résistance. Cette procédure est employée de façon répétée pour atteindre un diamètre urétral correspondant à Charrière 24 . Une fois cette taille de lumière atteinte, les calibrages ne sont plus nécessaires pour une longue période et les rechutes sur dilatations sont moins fréquentes.
Les sténoses sévères en diamètre ou en longueur doivent être abordées par des sondes filiformes après les avoir soigneusement lubrifiés à la xylocaïne.
Les sondes filiformes sont donc employées dans le cas de sténoses difficiles et peuvent être avancés à l'aveugle ou sous vision endoscopique. Si la manoeuvre à l'aveugle échoue, l'instrument est introduit par la lumière d'un urétroscope ou à l'extérieur de celui-ci. Une fois la sténose franchie, des bougies de calibre de plus en plus grand sont attachées à l'extrémité de la sonde filiforme et la dilatation se déroule sans crainte de créer une fausse lumière.
Si on redoute un problème de vidange incomplète après dilatation, qu'une fausse lumière a été créée ou qu'un saignement urétral abondant persiste, un cathétérisme supra-pubien percutané peut être mis en place pour quelques jours.
Généralement, une seule dilatation est insuffisante, et la procédure est répétée 3 et 9 semaines plus tard, afin que l'ouverture de la sténose se réépithélialise sans se refermer.
Le devenir des sténoses va s'apprécier dans les semaines ou les jours suivants la dilatation. Celles qui récidivent rapidement doivent généralement subir une urétrotomie sous vision directe ou une urétroplastie définitive.(Webster, G.D, J. Urol., 1995). Une urétrographie rétrograde devrait être réalisée environ 6 semaines après la dilatation initiale pour donner l'orientation du traitement à suivre.
L'urétrotomie interne
L'urétrotome de Otis développé au 19ème siècle a été supplanté par l'urétrotomie par vision directe qui permet à l'opérateur d'inciser uniquement la sténose de manière plus précise. L'essentiel dans l'urétrotomie est que l'incision pratiquée se réépithélialise sans se refermer. Cependant, une telle évolution favorable reste imprévisible et n'est pas influencée par une cathétérisation prolongée ou l'application d'une pression hydrostatique continue.(Barry, J.M., Urol. Clin. N. Amer., 1989; Carew, Laryngoscope, 1998)
L'urétrotomie d'Otis
L'urétrotome d'Otis est introduit le long de l'urètre. Sa lame est peu acérée et ne devrait pas trancher le tissu urétral normal mais uniquement les passages sténotiques. L'instrument est ouvert jusqu'à résistance et la lame du couteau retirée en position de midi, incisant ainsi la sténose. L'instrument est ensuite progressivement ouvert jusqu'à un diamètre de 24 F et le processus répété à chaque fois. L'urètre est ensuite cathétérisé pendant la réépithélialisation de l'urètre incisé et des bords de la sténose.
L'urétrotomie optique
Celle-ci permet une incision plus décisive de la sténose seule, que ce soit chez l'adulte ou chez l'enfant. Une anesthésie générale, spinale ou locale est employée dans la majorité des cas. Pour prévenir le risque d'épisodes bactériémiques, une antibiothérapie parentérale prophylactique est donnée en début d'intervention et per os en post-opératoire.
L'urétrotome est introduit jusqu'à vision directe de la sténose (figure 4). Parfois, la structure sténotique est telle que l'incision peut être réalisée sans autre. Par contre, si la sténose est serrée ou le trajet de sa lumière peu évident, un cathéter filiforme peut être introduit par l'urétrotome, et passé à travers le rétrécissement. Grâce à ce guide, l' incision est réalisée sans fausse route. Celle-ci se pratique à 12 h. pour éviter la vascularisation urétrale sauf dans l'urètre pénien où une incision à 3 et 9 h donne de meilleurs résultats à cause de la finesse du tissu spongieux qui entoure l'urètre et de l'adhérence de ce dernier aux structures voisines. Selon la répartition de la fibrose sur le pourtour de la sténose, l'incision est multi-radiaire. Si la sténose est postérieure, il est important de ne pas inciser trop profondément car la fibrose ou l'inflammation du tissu élastique peut entraîner des plaques fibreuses et éventuellement un cordée ventrale.
Un cathétérisme de 3 à 7 jours avec un cathéter de 18-20 Ch est recommandé. (Aagaard, J., Br J. Urol., 1987; Dahl, C., Ann Chir. Gyn, 1986; Nielsen, Ann. Chir. Gyn., 1985)
Différentes méthodes adjuvantes ont été proposées pour améliorer de taux de réussite de cette technique, telles que l'injection de stéroïdes ou une dilatation hydrostatique en comprimant l'urètre distal à la miction, mais n'ont pas été d'un grand secours. La meilleure technique complémentaire semble être l'auto-calibrage ou auto-dilatation par le patient lui-même après calibrage ou urétrotomie.(Robertson, G.S., Br J. Urol., 1991)
 Fig. 4 : Urétrotomie interne
(Campbell' s Urology, 1997)
Fig. 4 : Urétrotomie interne
(Campbell' s Urology, 1997)
Les complications, plutôt rares, sont des hémorragies localisées ou une extravasation urinaire ou d'un fluide utilisé. Des difficultés érectiles et des cas d'impuissance ont été rarement décrits.(Graverson, P.H., J Urol. Neph., 1991)
Une sténose de la partie sphinctérienne de l'urètre membraneux à la suite d'une fracture pelvienne ou de l'extension d'un processus inflammatoire peut aussi être traitée par urétrotomie, considérant que l'atteinte à la fonction sphinctérienne de l'urètre sera supplée par le col vésical si la jonction de ce dernier est intacte (Iselin C.E., J Urol, 1999). Par contre, à la suite d'une prostatectomie, l'urétrotomie se révélera peu judicieuse à cause du grand risque de compromission de la fonction urétrale. Le calibrage, s'il peut aussi mettre en péril la fonction sphinctérienne, le fera sur une brève durée.(Mundy, A.R., 1989)
Les stents urétraux
Ceux-ci sont relativement nouveaux dans la prise en charge des sténoses urétrales et sont surtout indiquées pour les courtes sténoses de l'urètre bulbaire. Faits en acier, en titane ou autre, ils sont placés le long de la sténose à la suite de sa dilatation ou de son incision optique. Délimitant initialement la lumière urétrale, il est recouvert d'un épithélium en 6 à 12 mois et sa mise en place endoscopique est relativement aisée.(Milroy, E., J Urol, 1993; Yachia, D., Ann Urol., 1993)
La complication la plus souvent rencontrée est une récurrence sténotique qui survient généralement aux extrémités du stent. Dans ce cas, un deuxième anneau doit être placé à la suite du premier. Une cicatrisation hypertrophique se voit fréquemment à la suite d'une première urétroplastie et d'une rupture urétrale sur fracture pelvienne. Une position trop proximale du stent peut contrecarrer le mécanisme du sphincter distal et compromettre la continence, surtout en cas de prostatectomie préalable. Des dysfonctions érectiles sont toujours à considérer mais réduites si le stent n'est pas placé dans la portion pénienne de l'urètre.
Des sténoses récidivantes au niveau du collet peuvent être levées par résection transurétrale mais la répétition de tels problèmes peut pousser à l'ablation du stent. La reconstitution urétrale est alors particulièrement difficile, car elle nécessite une urétroplastie circonférencielle, grevée d'un taux d'échec important.
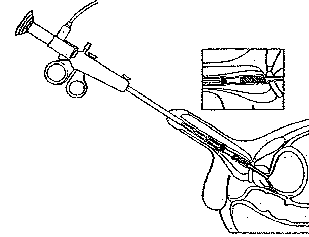 Fig. 5 : Les stents urétraux
(Campbell's Urology, 7th edition)
Fig. 5 : Les stents urétraux
(Campbell's Urology, 7th edition)
Traitement chirurgical
Une urétroplastie à ciel ouvert est nécessaire lorsqu'un traitement instrumental (dilatation, endoscopie, stent) est inapproprié ou impossible. Le choix de la méthode dépend de la localisation de la sténose, de son origine, de sa longueur, de son caractère unique ou multiple et de la présence de facteurs aggravants.
Depuis une quinzaine d'années, les réparations en un temps ont vu leur éventail s'agrandir, ce qui leur a permis de prendre l'ascendant sur les procédures en deux temps. Les patients ont bénéficié de cette évolution puisqu'ils récupèrent une miction per urethram plus rapidement et qu'une seule anesthésie est nécessaire.
La localisation et la longueur de la sténose est d'importance pour le choix du traitement. Hormis la balanite xérotique oblitérante, qui nécessite une reconstruction employant un tissu hétérotopique, l'étiologie de la sténose ne conditionne pas le type de méthode chirurgicale.
Les sténoses du méat
Essentiellement iatrogènes, elles surviennent souvent chez les jeunes à la suite d'une circoncision (Kunz, H.V., Prim Care, 1986), ou encore chez l'adulte, suite à des manoeuvres endoscopiques (par ex. TURP) et répondent le plus souvent à la dilatation périodique, le plus souvent par le patient lui-même.
La balanite xérotique oblitérante, atteignant non seulement le gland et le méat mais aussi le prépuce et l'urètre pénien, exige généralement une reconstruction chirurgicale du méat par différentes techniques.(Jordan, G.H., J Urol, 1987; De Sy, W.A., J Urol, 1984)
Les sténoses de l'urètre pénien
L'urètre pénien est la portion de l'urètre qui se situe entre le méat et le ligament suspenseur du pénis. Les causes d'un rétrécissement peuvent être l'extension d'une balanite oblitérante, une infection, un traumatisme dû à un cathéter ou à un autre instrument chirurgical.
Une urétroplastie anastomotique n'est pas appropriée: elle engendrera un raccourcissement urétral qui entraînera une cordée pénienne. Chez la plupart des patients toutefois, la réparation peut être faite en un temps au moyen d'un lambeau pédiculé transverse de peau pénienne selon Orandi.(Quartey, J.K.M., J Urol, 1983; Mundy, Br J Urol, 1988) Un lambeau de prépuce, résistant à l'humidité, peut parfaitement être employé avec un résultat cosmétique satisfaisant. Même après circoncision, un lambeau de peau pénienne peut souvent être utilisé.
Très souvent, le lambeau permet d'accroître le calibre urétral au site de sténose: l'ilôt est suturé après incision de la portion urétrale sténosée, rétablissant un diamètre urétral correct. (figures 2 et 3)
Les greffes de muqueuse buccale ou la marsupialisation urétrale suivie dans un deuxième temps opératoire d'une retubulisation amènent de bons résultats. Elles permettent le plus souvent le maintien du calibre urétral atteint lors de l'intervention sans engendrer une cordée antérieure.
La réparation en plusieurs étapes de l'urètre pénien ne se pratique que dans des cas difficiles, où les patients ont subi des interventions multiples ayant entraîné des phénomènes cicatriciels et rétractiles. Ces situations réclameront alors des greffes de peau totale extragénitale ou de muqueuse buccale pour recouvrir la surface pénienne antérieure après incision ou excision totale de la sténose. Dans un deuxième temps, le néourètre sera tubulisé à partir de la greffe et la peau pénienne native utilisée pour recouvrir le pénis. Dans de genre de procédure, les incertitudes liées à la prise de greffe et le taux de rétrécissement pénien peuvent amener à un cordée pénienne.
Les sténoses de l'urètre bulbaire
Elles sont essentiellement le résultat de processus inflammatoires ou traumatiques. La plupart des techniques d'urétroplastie conviennent à l'urètre bulbaire mais doivent être adaptées en fonction de la longueur sténosée, l'extension de la spongiofibrose, l'existence de fausses routes, de fistules, de cicatrisaton excessive, et de disponibilité de peau pénienne pour une substitution urétrale.
Les sténoses allant jusqu'à 1 cm avec urètre adjacent sain peuvent être traitées par excision de la sténose et réanastomose. Au delà de cette longueur, la mobilisation urétrale pénienne nécessaire pour réaliser une anastomose sans tension devra être faite au-delà du ligament suspenseur du pénis, ce qui aboutit à une cordée inacceptable. Ces sténoses de plus de 1 cm nécessitent parfois une plastie par greffon interposé dans l'incision de la sténose, qui se faisait, jusqu'au début des années 1990, ventralement. (Presman, D., J Urol, 1953, Devine, P., J Urol, 1963). La récente idée de placer le greffon dorsalement (Barbagli G., J Urol, 1996, Iselin C.E., World J. Urol., 1998), afin de permettre une fixation bien étalée et une bonne prise de celui-ci, semble nettement plus efficace (Andrich, D., J Urol, 2001). Des sténoses allant jusqu'à 8-9 cm de long sont aussi réparées avec un taux de succès élevé (Barbagli G., J Urol, 1998; Iselin C. E., J Urol, 1998; Iselin C.E, eur Urol, 2000).
La sténose très serrée peut être excisée et une anastomose des bords ventraux est associée à la plastie par greffon dorsal (Iselin C. E, World J Urol, 1998).
Une reconstruction urétrale bulbaire en 2 temps est nécessaire dans les rares cas où une procédure en un temps a peu de chances de réussir : des sténoses longues et complexes accompagnées de cicatrisation extensive, d'inflammation, de fistules, de faux passages et de diverticules.
Les sténoses de l'urètre postérieur
Les sténoses de l'urètre postérieur ou membraneux sont provoquées communément par des ruptures urétrales à la suite de fracture pelvienne ou surviennent à la suite de prostatectomies.
La plupart des fractures pelviennes ne causent qu'une simple contusion ou élongation urétrale avec peu de séquelles. Si une rupture se produit, elle peut être partielle ou complète.
La prise en charge d'une contusion ou d'une élongation urétrale se fait par un cathétérisme temporaire alors que celle d'une rupture est sujet à controverse. Une fois le diagnostic posé par urétrographie rétrograde, il faut exclure une rupture vésicale et examiner l'arbre urinaire par une urétrographie mictionnelle.
Les patients avec atteinte rectale associée qui nécessitent une exploration pour drainage d'hématome ou pratique d'une colostomie doivent être opérés d'urgence. Un réalignement urétral sur un cathéter comme guide est approprié dans cette situation. (Webster, G.D., J Urol, 1983)
A part les cas où la fracture atteint l'urètre prostato-membraneux et le col vésical où une intervention destinée à débrider et à réparer le col vésical est nécessaire, la plupart des situations laissent la porte ouverte à différentes options.
A) Le réalignement urétral immédiat
L'avantage serait le prise en charge immédiate du problème et l'épargne d'un cathétérisme suprapubien prolongé. Cependant, les conditions sont rarement favorables pour une intervention immédiate après fracture pelvienne et aboutissent souvent à des saignements catastrophiques et la dysfonction érectile consécutive est fréquente. Malgré cela, il est certain que moins de patients auront besoin d'une urétroplastie après un tel traitement. ( Webster, G.D., J Urol, 1983; Follis, W.H., J Urol, 1992)
B) La réparation primaire différée
Celle-ci implique que le patient atteint d'une rupture complète de l'urètre à la suite d'une fracture pelvienne soit équipé d'un cathéter suprapubien et que la rupture soit ensuite réalignée endoscopiquement sur un cathéter-stent ou réparée chirurgicalement à la prochaine occasion (habituellement dans les 10 jours) lorsque la situation du patient le permet. L'avantage de cette option est d'éviter le haut risque d'exploration pelvienne durant la période post-traumatique immédiate.
C) La réparation secondaire
Celle-ci se divise en deux groupes :
-
les procédures endoscopiques, y compris l'urétrotomie sous vision directe et la dilatation urétrale.
-
les techniques chirurgicales ouvertes, en particulier les urétroplasties anastomotiques et de substitution.
1) Le traitement endoscopique différé
Le rôle de la dilatation urétrale et de l'urétrotomie de vision directe est bien établi pour le traitement des sténoses non-oblitératives de l'urètre membraneux à la suite de déchirures partielles. Elles ne sont pourtant que rarement curatives.
L'urétrotomie visuelle dans le cas de sténoses oblitératives du même segment urétral est sujet à controverse. Cette procédure, si elle épargne au patient une urétroplastie en cas de succès, est grevée de complications telles que faux passages, fistules ou de cicatrices denses nécessitant des dilatations répétées voire une urétroplastie. (Barry, J.M., Urol Clin N Am, 1989; Marshall, Urol Clin N Am, 1989; Spirnak, J.P., J Urol, 1993)
2) Le traitement chirurgical différé
Le traitement par technique anastomotique en un temps reste probablement la meilleure solution, des réparations de ruptures de 7 cm ayant été réalisées par cette technique. On dispose de 4 procédés (mobilisation urétrale, séparation des corps caverneux, encoche dans l'os pubien, reroutage de l'urètre en-dessus de l'un des corps caverneux) cumulatifs, qui permettent le plus souvent de ponter le défect urétral. Un délai de 3 mois avant l'intervention est généralement suffisant. Une urétrographie rétrograde doit permettre d'évaluer la longueur de la rupture, la compétence du sphincter vésical et la normalité de l'urètre antérieur. Une cystoscopie rétro-et antérograde permet de confirmer les résultats radiographiques. (Webster, G.D., J Urol, 1991)
Les complications peuvent être une incontinence, généralement due à une lésion du col vésical méconnue en pré-opératoire (Iselin C.E., J Urol, 1999), corrigible par voie rétropubienne secondairement.
Les facteurs qui compliquent cette technique chirurgicale sont de longues pertes de substance urétrale, une cavité périurétrale chronique, des fistules rectales, cutanées et périurétrales, une incontinence, une sténose urétrale antérieure associé, des facteurs limitant l'accès chirurgical et une histoire de tentative préalable de réparation avortée. (Webster, G. D., J Urol, 1990)
2a) Traitement combiné abdomino-périnéal et transpubien
Celui-ci est utilisé dans certains centres et lors de présence de trajets fistuleux, ou de cavités dans le plancher pelvien. (McAninch, J. W., Urol Clin N Am, 1989)
2b) L'urétroplastie de substitution
Cette approche, autrefois privilégiée par de nombreux chirurgiens, est aujourd'hui réservée aux cas où une sténose urétrale antérieure compromet le flux sanguin urétral rétrograde, prévenant ainsi une réparation anastomotique ou aux rares situations dans lesquelles le défaut, plus long que 7 cm, empêche une anastomose primaire. Cette technique se déroule en un temps avec l'utilisation d'ilôts de peau pédiculés et de greffes de peau totale ou en deux temps par différentes interventions faisant appel à greffes et lambeaux. (Morehouse, D.D., Urol Clin N Am, 1989)
Limitations des principaux traitements actuels
La principale complication de toutes les modalités thérapeutiques actuelles réside dans la survenue d'une récidive de sténose qui, selon la fréquence et au moment où elle apparaît après traitement, détermine l'efficacité de celui-ci. Certaines complications sont plus spécifiquement liées à certaines techniques :
Les complications immédiates de l'urétrotomie interne sont essentiellement l'hémorragie et l'extravasation urinaire, rares actuellement, entraînant l'infection et à plus long terme, outre la resténose, les dysfonctions érectiles et l'incontinence.
Les stents urétraux sont susceptibles d'être à l'origine de resténoses essentiellement à leurs extrémités par la cicatrisation hypertrophique qu'ils peuvent engendrer de même que les troubles de la continence et de l'érection.
Les approches chirurgicales peuvent causer des hématomes péri-urétraux, des fistules urétro-cutanées, aussi bien que des problèmes d'incontinence ; la récurrence de la sténose dans des procédures de substitution est essentiellement liée à la détérioration des tissus utilisés comme substrat d'urètre.
Le traitement par laser trouve son principal intérêt, comme indiqué dans la partie intitulée " laser et cicatrisation " dans l'ablation du tissu cicatriciel et dans la prévention de la resténose par l'absence théorique de processus cicatriciel qui préside à la formation d'une nouvelle sténose.
Les stents urétraux, qui restent une procédure de seconde intention (utilisés quasi exclusivement suite à l'échec d'autres traitements) sont susceptibles d'être à l'origine de resténoses essentiellement à leurs extrémités par la cicatrisation hypertrophique qu'ils peuvent engendrer de même que les troubles de la continence et de l'érection.
La dilatation urétrale entraîne essentiellement des risques infectieux, de même que des troubles de la continence. Elle constitue un traitement " chronique " dans la mesure où elle doit être régulièrement répétée pour être efficace.
Résultats comparatifs des principales techniques thérapeutiques
Le tableau ci-dessous récapitule les résultats des principales modalités thérapeutiques actuelles en présentant les diverses études y relatives comportant le plus grand nombre de patients avec un temps de recul le plus important et dont les données sont les plus fiables quant à la méthodologie employée pour le recueil et l'analyse de celles-ci.
On constate que le taux de succès des procédures chirurgicales est le plus grand, que celui de l'urétrotomie interne est très variable selon les séries et que les traitements au laser perdent de leur efficacité au fil du temps.
| Tabl. 1 : Récapitulatif des principales modalités thérapeutiques actuelles |
| Technique |
Etude |
Nbre de patients |
Recul moyen |
Succès (%) |
| Laser argon |
Becker, Urol Int, 95 |
450 |
10 ans |
30 |
| Laser KTP |
Schmidlin F, Ann Urol, 97 |
20 |
6 mois |
81 |
| Laser KTP |
Turek J, Endourol, 92 |
31 |
9,7 mois |
59 |
| Laser Ho :YAG |
Kural AR, J Endourol, 00 |
13 |
27 mois |
69 |
| Laser Nd:YAG |
Perkash I, J Urol, 97 |
42 |
28,2 mois |
93 |
| Laser Nd:YAG |
Smith A, J Urol, 89 |
24 |
12 mois |
33 |
| Laser Nd:YAG |
Smith A, J Urol, 84 |
17 |
6 mois |
36 |
| |
|
|
|
|
| Urétrotomie interne |
Benchekroun A, Ann Urol, 98 |
100 |
2,5 ans |
54 |
| Urétrotomie interne |
Albers P, J Urol, 96 |
937 |
3,8 ans |
64 |
| Urétrotomie interne |
Pansadoro V, J Urol, 96 |
224 |
8 ans |
32 |
| Urétrotomie interne |
Giannakopoulos X, J Urol, 92 |
70 |
5 ans |
36 |
| |
|
|
|
|
| Urétroplastie |
Santucci RA, J Urol, 02 |
168 |
70 mois |
95 |
| Urétroplastie |
Micheli E, BJU, 02 |
74 |
5 ans |
90 |
| Urétroplastie |
Barbagli G, J Urol, 01 |
93 |
14 ans |
85 |
| Urétroplastie |
Guralnick ML, J Urol, 01 |
29 |
28 mois |
93 |
| Urétroplastie |
Barbagli G, J Urol, 97 |
98 |
53 mois |
80 |
| Urétroplastie |
Rogers HS, Br J Urol, 92 |
194 |
11 ans |
93 |
| Urétroplastie |
Hermanow. M, An Urol, 90 |
140 |
5 ans |
48 |
Les lasers
Principe physique
Le terme laser se réfère à l'abréviation anglaise " light amplification by stimulated emission of radiation " (amplification de lumière par émission stimulée de rayonnement). Un faisceau laser, à la différence de la lumière blanche, est donc composé de photons de même longueur d'onde (faisceau monochromatique) se propageant parallèlement les uns les autres dans l'espace, dans le même direction (cohérence spatiale) et avec la même fréquence (cohérence temporelle). ( Boulnois J., Lasers in Med Sci, 1986)
Chaque laser est constitué de 3 éléments de base :
-
un milieu actif contenant des atomes spécifiques (d'un gaz tel que Ar+ ou CO2, d'un solide tel que le Nd :YAG ou d'un liquide tel qu'un colorant) dont la nature détermine la longueur de l'émission laser,
-
une source d'énergie extérieure (lumière, chaleur ou énergie électrique)
-
un résonateur optique avec deux miroirs réfléchissants au centre desquels se trouve le milieu actif.
 Fig. 6 : Principe du laser
(tirée de Adult and Paediatric Urology, Gillenwater J.Y., 2nd edition, 1995, p.358)
Fig. 6 : Principe du laser
(tirée de Adult and Paediatric Urology, Gillenwater J.Y., 2nd edition, 1995, p.358)
La plupart des lasers utilisent l'énergie électrique comme source d'énergie. Le milieu actif est contenu dans le résonateur. La lumière sort directement ou est focalisée par une lentille convergente ( Figure 6.
Pour atteindre ce type d'amplification de lumière, le milieu actif doit d'abord être parcouru par une forme d'énergie extérieure de sorte qu'un grand nombre de ces atomes absorbe suffisamment d'énergie pour passer à un stade d'excitation supérieur, à partir duquel une émission spontanée de photons commence à mesure que les atomes excités retournent à leur état initial. Dès le moment où chaque type de milieu actif atteint un niveau d'énergie spécifique et émet spontanément son excès d'énergie, des photons de longueur d'onde caractéristique du milieu sont émis. L'émission stimulée se produit lorsqu'un photon émis entre en collision avec un atome excité qui a absorbé une quantité d'énergie égale à celle du photon qui l'a percuté et qui libère à son tour un photon. Les deux photons ont la même longueur d'onde, sont en phase et progressent dans la même direction.
L'amplification de lumière se produit par rebond d'une certaine partie de l'arrière ou de l'avant du photon à travers le milieu actif délimité à ses extrémités par deux miroirs. Le miroir du côté qui émet le faisceau laser est partiellement réfléchissant, d'une part laissant passer une partie des photons qui le heurtent pour qu'ils constituent l'émission laser, d'autre part en réfléchissant le reste des photons en direction du milieu actif pour qu'ils continuent à stimuler la libération d'autres photons par les atomes excités. Le miroir qui lui fait face réfléchit l'ensemble des photons qui viennent le frapper en direction du milieu actif et du premier miroir. En conséquence, un certain pourcentage des photons ainsi générés fait le va-et-vient entre les deux miroirs à la vitesse de la lumière, stimulant ainsi l'émission d'autres photons par les atomes excités.
Le faisceau laser est ainsi monochromatique, cohérent et très intense puisqu'il est le résultat d'un processus d'amplification d'émission stimulée d'un rayonnement.
La nature cohérente du faisceau permet de le focaliser par des lentilles en des endroits dont le rayon peut être théoriquement égal à la moitié de la longueur du faisceau. Tous ces photons peuvent donc être très étroitement canalisés pour atteindre un débit de photons gigantesque à un endroit donné. Un faisceau laser peut ainsi être employé pour concentrer de l'énergie pour la délivrer très rapidement sur une surface très restreinte. ( Schmidlin F., Med et Hyg, 1996 ; Lanzafam R.J., Lasers Surg Med, 1984 ; Smith J.A.Jr, Year Book Medical Publishers, 1985)
Puissance du faisceau et densité de puissance
La puissance d'un faisceau laser peut être envisagée comme la capacité du faisceau à délivrer de l'énergie sur sa cible par unité de temps et ainsi d'accroître le mouvement vibratoire des atomes et molécules de la cible. La densité de puissance, quantité de puissance par étendue de surface, est calculée en divisant la puissance émise par le laser (habituellement en watts) par la surface de la cible du rayon laser. Dans la mesure où la cible est ronde, la surface sera définie par la formule S=ppr2 où S est la surface et r le rayon de la cible. Ainsi, la densité de puissance varie inversement proportionnellement avec le carré du rayon. Le chirurgien doit toujours avoir à l'esprit que :
-
premièrement le taux d'ablation est directement proportionnel à la densité de puissance : plus la densité de puissance est grande, plus la vitesse d'ablation le sera
-
deuxièmement, la zone d'atteinte thermique au-dessous de la surface tissulaire varie avec la densité de puissance : par faible densité de puissance, le tissu est chauffé lentement et permet à la chaleur de diffuser dans les couches sous-jacentes. Dans le cas contraire, les surfaces tissulaires sont rapidement portées à la température d'ébullition de l'eau intracellulaire, point à partir duquel une large proportion de l'énergie du faisceau se dissipe sous forme de vapeur d'eau, carbonisant ainsi les composants cellulaires organiques. Le reste de la chaleur est transmis aux couches inférieures, mais comme le processus est relativement lent par rapport à l'évaporation, la chaleur ne progresse pas bien loin avant d'être rattrapée par le front d'évaporation et les dommages qu'il entraîne. De ce fait, la zone d'atteinte thermique sous la surface tissulaire est augmentée lors de faible intensité de puissance et diminuée lors de forte intensité de puissance. Plus l'intensité de puissance est grande, moins le dommage tissulaire thermique est grand. (Smith's General Urology, 13rd International Edition, 1998)
Les lasers à ondes continues et les lasers à ondes pulsées
Il y a fondamentalement deux modes de libération d'énergie pour chaque type de laser, les modes à onde pulsée et à onde continue. La libération d'énergie par onde continue est la même que celle d'une lumière de flash ; l'intensité de lumière par unité de temps est constante. Les lasers pulsés sont semblables aux lumières de stroboscope ; l'énergie est délivrée sous la forme de séries de flashs intenses de très courte durée (de l'ordre de la milliseconde ou de la nanoseconde). Comme pour la lumière stroboscopique, les impulsions, si elles sont délivrées à une cadence suffisamment rapide, peuvent donner au faisceau un aspect continu, mais la différence-clé est que le niveau d'énergie délivrée durant une impulsion (puissance maximale) est beaucoup plus grand que celui d'un laser à onde continue pour une même période de temps. (La puissance maximale désigne le taux maximum de libération d'énergie pendant le temps d'une impulsion. Pour délivrer une quantité donnée d'énergie au travers d'un nombre donné d'impulsions sur un intervalle donné exige que le taux d'énergie délivré à chaque impulsion soit très important. Pourtant, la quantité totale d'énergie lors de chaque impulsion est faible, l'intervalle de libération étant extrêmement court). (Buson R.C., Eur Urol, 1986 ; Harty J.I., J Urol, 1989 ; Nsey U.O., Cancer, 1987)
La création d'un faisceau laser pulsant peut être effectuée de deux différentes manières. ( Coptcoat M.J., Br J Urol, 1988 ; Segura J.W., Urol Clin North Am, 1988 ; Zerbib M., J Urol, 1990 ; Zerbib M., Urol Clin North Am, 1988). La première consiste à fournir l'énergie d'activation du milieu actif sous forme pulsée. La seconde se fait par un processus appelé inversion-Q, que l'on obtient en introduisant un volet rapide entre le milieu actif et le miroir de sortie. En gardant simultanément le volet fermé et en pompant l'énergie d'activation dans le milieu actif, celle-ci est enfermée comme les photons dans le milieu actif. Par conséquent, il se produit une accumulation très rapide d'énergie dans le milieu actif. Lorsque le volet s'ouvre, l'énergie est libérée quasiment instantanément (dans l'ordre de la nanoseconde) avec comme résultat un pic de puissance d'impulsion énorme. L'inversion-Q est fréquente dans les lasers industriels mais moins souvent utilisée dans les lasers à usage médical, à l'exception de la fragmentation des calculs urétéraux. La limite principale de cette technique provient de la conduction de l'énergie du laser au travers des fibres optiques. Les flux d'énergie à l'entrée de la fibre dépassent le seuil de tolérance des matériaux des fibres même à des niveaux de longueur d'onde facilement transmis sur le mode d'onde continue. L'introduction d'un Nd :YAG
(neodymium : yttrium-aluminium garnet)-laser fonctionnant sur la principe de l'inversion-Q et susceptible d'être conduit par une fibre optique laisse présager de nouveaux développements en la matière.
Principes de manipulation du laser
L'avantage majeur du laser pour la chirurgie est qu'un large flux d'énergie peut être très précisément dirigé sur un tissu-cible dans l'intention de le détruire de façon contrôlée. Les effets spécifiques du faisceau-laser sur le tissu dépendent de la longueur d'onde du faisceau, de la transparence du tissu au rayonnement et de l'intensité de l'énergie laser reçue dépendante de la taille de la surface concernée et de la puissance faisceau. (Figure 7) (Lanzafam R.J., Lasers Surg Med, 1984; Smith J.A.Jr, Year Book Medical Publishers, 1985; Smith's General Urology, 13rd International Edition, 1998)
La cicatrisation et le processus de réparation tissulaire dépendent largement de la taille et du type de dommage fait au tissu immédiatement adjacent à la zone traitée. (Venzi G., Eur Urol, 1999 ; Carew J.F., Laryngoscope, 1998 ; Laranne J., Acta Otolaryngologica, 1997) Si le but est d'éviter le plus possible un processus de cicatrisation post-opératoire, et c'est quasiment toujours le cas, le chirurgien doit être à même non seulement d'utiliser le laser adéquat mais également de léser le moins possible les tissus entourant la cible avec le faisceau.
Par la petite zone de dommage thermique sous le cratère de la plaie produite par une plage de haute intensité de puissance, la blessure va guérir en produisant moins de cicatrice. La relation n'est pas dépendante du laser utilisé, l'important étant que pour accomplir une évaporation tissulaire rapide, les lasers dont la lumière est peu absorbée par le tissu doivent être focalisés sur des densités de puissance beaucoup plus larges. Malgré tout, la zone de dommage thermique sous la blessure sera plus large que dans le cas des lasers dont le rayonnement sera plus fortement absorbé par le tissu.
 Fig. 7 : Principe de manipulation du laser selon la convergence du faisceau
(tirée de Smith's General Urology, 13rd International Edition, 1998, p. 441)
Fig. 7 : Principe de manipulation du laser selon la convergence du faisceau
(tirée de Smith's General Urology, 13rd International Edition, 1998, p. 441)
Effets des lasers sur les tissus biologiques
L'interaction des photons sur un tissu donne 4 principaux effets dépendant de la densité de puissance du faisceau et de sa durée d'interaction avec le tissu (donc de l'énergie apportée à la surface).
1. Effet photoablatif
L'action photoablative, aussi appelée photodécomposition ablative, est basée sur l'utilisation de photons présentant une énergie supérieure à l'énergie de liaisons des molécules biologiques. Le processus photoablatif consiste ainsi en une dissolution ou une rupture de la matière et de l'expulsion des fragments à une vitesse supersonique. Des photons ayant une énergie de l'ordre de 3 à 5 MeV sont susceptibles de dissocier les liaisons peptidiques ou les liaisons carbone-carbone des chaînes polypeptidiques, provoquant une ablation du tissu sans autre phénomène thermique. Ces effets sont surtout recherchés en ophtalmologie. ( Mordon S., Ann Urol, 1997)
2. Effet photochimique
Pour obtenir cet effet, on utilise un agent photosensibilisant que l'on applique sur le tissu avant de le soumettre à un faisceau laser dont la longueur d'onde correspond au pic d'absorption de l'agent utilisé photosensibilisant. Celui-ci, après absorption de lumière qui le fait passer à un niveau d'excitation supérieur, émet soit un rayonnement de fluorescence (photodétection), soit des substances toxiques (photothérapie). Pour obtenir ces effets, on utilise de faibles densités de puissance et de longues durées d'exposition. La photodétection et la photothérapie de tumeurs superficielles de la vessie sont les indications principales rencontrées en urologie. (Mordon S., Ann Urol, 1997)
3. Effets mécaniques
Lorsqu'une impulsion laser de très courte durée (micro- ou nanoseconde) est focalisée sur une cible tissulaire, créant ainsi des irradiations élevées (de l'ordre de 10 puissance 10 ou 12 W/cmcarré), il est possible d'obtenir localement des champs électriques élevés (10 puissance 6 à 7 V/mcarré) comparables aux champs atomiques ou intramoléculaires. De tels champs induisent un bouleversement électrique du matériau de la cible ayant pour résultat la formation d'un plasma (gaz ionisé). L'onde de choc associée à l'expansion du plasma engendre des ondes de pression extrêmement importantes et par conséquent une rupture mécanique de la structure tissulaire. Cette action mécanique est le plus souvent obtenue avec des lasers Nd :YAG fonctionnant en mode continu (nanosecondes) ou en mode bloqué (piccosecondes). (Halldorsen T.H., Lasers Surg Med, 1981 ; Hofstetter A., lasers Surg med, 1986 ; Malloy T.R., Urology, 1988 ; Marchesini R., Lasers Surg Med, 1985 ; Smith J.A., J Urol, 1986)
4. Effet thermique
Ils résultent d'une succession de 3 phénomènes distincts : la conversion de la lumière en chaleur, le transfert de chaleur par absorption et diffusion dans le tissu et la réaction tissulaire due à l'échauffement. ( Figure 8 )
 Fig. 8 : Effets thermiques du laser
(tirée de Mordon S., Ann Urol, 1997, 31, n°1, p.14)
Fig. 8 : Effets thermiques du laser
(tirée de Mordon S., Ann Urol, 1997, 31, n°1, p.14)
La conversion de lumière en chaleur
La source de chaleur est induite par conversion de la lumière en chaleur selon le principe suivant : l'énergie apportée par un photon va, après conversion, conduire une molécule à un niveau d'énergie vibratoire et ensuite par collision inélastique avec une autre molécule à l'accroissement de l'énergie cinétique. Cette énergie est distribuée spatialement en fonction des paramètres lasers mais aussi des coefficients optiques du tissu. Avant même l'absorption du faisceau, la réflexion optique à la surface de la peau peut atteindre des valeurs élevées dans le domaine de la lumière visible (20 % à 520 nm) et plus faibles dans le domaine de l'infra-rouge ou pour d'autres tissus biologiques. Les multiples modifications de trajectoires liées aux réflexions, réfractions et diffractions présentes dans les tissus vivants sont assimilées à un phénomène de diffusion optique, modifiant ainsi la direction du rayon incident. L'extinction du faisceau (la conversion des photons) sera proportionnelle à des coefficients d'absorption et de diffusion. Pour les longueurs d'onde inférieures à 590 nm, l'hémoglobine est le chromophore prédominant et présente donc une forte absorption. Par contre, dans le rouge et le proche infra-rouge, le coefficient de diffusion contribue à presque 90 % à l'extinction du faisceau laser car ni le sang ni l'eau n'absorbent dans ce domaine de longueur d'onde. Par contre, pour les longueurs supérieures à 1,8 micron, l'absorption de l'eau est extrêmement importante et le coefficient d'absorption joue un rôle très important. Un choix judicieux de la longueur d'onde vis-à-vis des dimensions de la cible, de sa position et ses coefficients optiques est essentiel pour l'effet de l'action thermique. Un vaisseau en profondeur sera, par exemple, touché par un faisceau-laser de longueur d'onde bien absorbée par l'hémoglobine mais peu par le tissu environnant.
Transfert de chaleur
Ce mécanisme joue un rôle essentiel car il conditionne en grande partie les dimensions de l'action thermique par la création de gradients de température au sein du tissu. En effet, dans les tissus vivants, il existe deux principaux mécanismes de transfert de chaleur, la convection et la conduction. La convection implique un transport de masse alors que la conduction implique un transport de chaleur sans transport de masse. Dans le cas d'une irradiation laser, le transfert de chaleur via les vaisseaux sanguins, généralement considérés comme vecteur important de convection, n'intervient quasiment pas et aucune convection macroscopique n'apparaît. La conduction de chaleur est donc le mécanisme prédominant, intervenant par interaction des particules du tissu. Ce transfert s'effectue aléatoirement des particules les plus énergétiques à celles qui le sont le moins. Une notion importante à ce stade est celle du temps de relaxation thermique qui correspond à la durée nécessaire au transfert d'énergie en dehors de la cible, permettant d'obtenir au milieu de la cible une diminution de la température à une valeur équivalente à la moitié de la valeur maximale atteinte. La conséquence est donc le refroidissement de la cible, et grâce aux processus de transfert de chaleur, une élévation de température des tissus adjacents à la cible. Ceci dépend des dimensions de la cible et de son volume.
Une autre notion fondamentale est le temps d'impulsion du laser, à savoir le temps de transfert d'énergie par le laser. En effet, si la conversion de lumière conduit à une source de chaleur dont les dimensions sont tout d'abord déterminées par la cible, la zone affectée thermiquement va dépendre de l'expansion de cette source de chaleur. Cette expansion dépend du temps d'impulsion vis-à-vis du temps de relaxation thermique. Trois cas de figure sont à distinguer :
Le temps d'impulsion est beaucoup plus court que le temps de relaxation thermique : l'énergie créée n'a pas le temps de diffuser. Il y a donc accumulation de chaleur dans la cible et naturellement augmentation de température importante. Si le volume reste constant, la hausse de température amène à une augmentation de pression et, au-delà d'une certaine valeur, à une explosion de la cible. On obtient ainsi l' effet mécanique détaillé ci-dessus. La destruction des calculs au moyen du laser à colorant pulsé est en grande partie basée sur ce phénomène.
Le temps d'impulsion du laser est de l'ordre du temps de relaxation thermique de la cible. La zone affectée thermiquement est 2 à 3 fois plus grande que la source de chaleur. Ainsi, on obtient uniquement un effet thermique dont l'intensité sera modulée par l'intensité de la source laser. Il est alors possible de coaguler ou de volatiliser des structures tissulaires. Les sténoses urétrales, mais aussi les tumeurs de la vessie et les hypertrophies de prostate sont approchées par ce moyen.
L'utilisation d'une durée d'impulsion laser très supérieure au temps de relaxation thermique de la source fait perdre toute sélectivité optique puisqu'il y a un important transfert de chaleur à distance. Cet effet peut être utile pour le chauffage d'importants volumes tissulaires, par exemple dans le traitement de l'hypertrophie bénigne de prostate. Le contrôle de l'effet thermique reste cependant très aléatoire est les risques du sur- ou sous-dosage sont importants.
Ainsi, si le choix de la longueur d'onde doit être judicieux, celui de la durée de l'impulsion laser l'est tout autant. Ce choix de la durée d'impulsion conditionne immédiatement le choix de l'intensité du laser ou plus exactement de son irradiation (W/mcarré). Si l'action thermique du laser est dépendante de l'énergie (nombre de photons) appliquée au tissu, le mécanisme de transfert de chaleur permet de saisir qu'à énergie équivalente, l'utilisation d'un temps court et par conséquent d'une irradiation élevée ou le recours à un temps d'exposition relativement long et par conséquent à une irradiation beaucoup plus faible auront des conséquences tissulaires bien différentes.
Dommage tissulaire
La troisième étape est l'étape thermochimique qui va conduire au dommage tissulaire et par conséquent à la dénaturation ou à la destruction du tissu. La cinétique de cette étape dépend de la température des tissus et de son évolution temporelle, les vitesses de dénaturation tissulaire dépendant quant à elles de la structure moléculaire des tissus à transformer. Les vitesses de dénaturation tissulaire doivent être élevées alors que la modification des constituants cellulaires requiert des cinétiques de transformation et des énergies d'activation très différentes.
Dommage thermique sur les constituants cellulaires
D'une manière générale et pour des durées de chauffage de l'ordre de la seconde, il est admis que dès 45°C apparaissent des phénomènes de vasodilatation et de dommage endothélial conduisant à la mort cellulaire. A 50 °C, il y a disparition de l'activité enzymatique. La désorganisation des membranes est obtenue à 60 °C, ainsi que la dénaturation de certaines protéines. Les protéines sont formées de chaînes polypeptidiques, dont la structure tertiaire est définie par des liaisons fortes (ponts disulfures) et faibles (liaisons hydrogènes et liaisons hydrophobes). La chaleur n'altère pas les ponts disulfure, ni les liaisons covalentes, mais elle rompt les liaisons hydrogène. Les protéines dénaturées présentent alors un rapport axial plus élevé, donc une structure plus allongée. Elles sont plus visqueuses en solution. Le collagène, protéine dont la structure est plus hiérarchisée, présente une plus grande résistance à la température. Le procollagène se présente sous la forme d'une triple hélice polypeptidique maintenue en place par les liaisons hydrogène. L'association par des liaisons covalentes de plusieurs unités de procollagène forme une fibrille collagène. C'est l'association de plusieurs fibrilles par l'intermédiaire de liaisons ioniques et hydrogène grâce à la présence d'eau (liquide interstitiel) qui forme une fibre collagène. L'échauffement produit une évaporation de l'eau du liquide interstitiel, conduisant à une disparition des liaisons hydrogène interfibres. La chaleur provoque simultanément un démasquage des groupements réactifs susceptibles de former des liaisons hydrophobes. Ceci implique un accroissement important de ces liaisons hydrophobes et glycoprotéiques qui forment une " colle ", la fibronectine. Ce processus qui apparaît vers 75°C modifie la structure tissulaire et s'accompagne d'une rétraction tissulaire avec une déshydratation pratiquement totale. Si la température s'élève rapidement à 100°C, la vaporisation du liquide interstitiel conduit à la volatilisation des constituants cellulaires et à la destruction de l'architecture des tissus. Cette étape consomme beaucoup d'énergie (2539 Joules par gramme d'eau), créant un phénomène de pompe à chaleur qui permet de limiter le transfert de chaleur aux tissus adjacents. Enfin, dès que l'eau a disparu, et ce en fonction de la température atteinte, prennent effet des phénomènes de carbonisation et/ou de combustion des constituants organiques.(Figure 9)
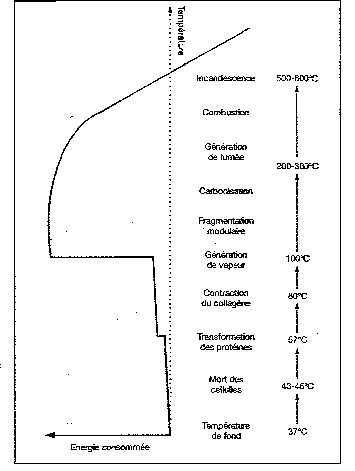 Fig. 9 : Conséquences de l'énergie thermique produite par le laser sur les tissus biologiques
(tirée de Mordon S., Ann Urol, 1997, 31, n°1, p.17)
Fig. 9 : Conséquences de l'énergie thermique produite par le laser sur les tissus biologiques
(tirée de Mordon S., Ann Urol, 1997, 31, n°1, p.17)
L'action thermique des lasers est donc essentiellement utilisée pour la coagulation et la volatilisation des constituants cellulaires. Il est d'ailleurs évident que les trois étapes présentées successivement plus haut se déroulent simultanément.
D'une façon générale, l'utilisation de temps d'exposition du même ordre de grandeur que le temps de relaxation thermique de la cible est à privilégier car des temps d'exposition trop longs conduisent à des effets à distance difficilement contrôlables.
Enfin, la notion de dommage thermique doit être considérée avec beaucoup d'attention d'autant plus qu'il faudra distinguer le dommage thermique immédiat du dommage obtenu à 24 ou 48 heures qui est souvent le résultat de nécrose ischémique par lésions des vaisseaux sanguins.
A noter encore que les effets thermiques sont recherchés dans 80% des utilisations médicales du laser.
Types de laser et utilisation
Le spectre des pathologies urétrales que l'on peut traiter par laser n'est pas tant restreint par l'utilisation des lasers eux-mêmes que par les limites techniques des endoscopes permettant leur utilisation. Les lasers d'utilisation courante en clinique sont le laser CO2, laser Nd :YAG, ses dérivés les lasers Holmium :YAG et laser KTP, le laser argon, le laser argon pompé et le laser à lampe flash pulsée. Les lasers CO2 et Nd :YAG étant les plus employés, chacun est capable de développer une grande puissance (100 Watts) et est susceptible de couper ou de coaguler les tissus biologiques.
Le laser CO2
Il émet un faisceau d'une longueur d'onde assez importante de 10600 nm, qui est fortement absorbée non seulement par l'eau mais aussi par les protéines, les acides nucléiques et les graisses. Par conséquent, l'énergie délivrée par le faisceau est complètement absorbée, essentiellement par la surface du tissu-cible, avec comme résultat un ébouillantage et noircissement de la surface. Le tissu est instantanément vaporisé, entraînant un cratère recouvrant une fine couche de nécrose thermique.
Le laser CO2 est potentiellement le meilleur car son pouvoir ablatif excellent engendre des plaies à guérison rapide et à séquelles cicatricielles minimes. Malheureusement, tous les matériaux optiques utilisés absorbent le faisceau, rendant difficile la construction d'endoscopes permettant son utilisation vésicale ou urétrale. Son emploi se limite donc aux lésions de surface telles que les condylomes acuminés, les carcinomes in situ cutanés ou glandulaires et les caroncules ou condylomes du méat urétral. Les lésions évoluent avec un minimum de douleurs post-opératoires et de tissu cicatriciel, prévenant ainsi la nécessité de résection cutanée ou de greffe.
Le traitement des sténoses urétrales se limite aux rétrécissements du méat urétral et de la fosse naviculaire où les résultats semblent encourageants puisque l'utilisation du laser CO2 ne semble pas laisser de cicatrice du tout. (Hall R.R., Nature, 1971 ; Mc Kenzie A.L., Phys Med Biol, 1983 ; Walsh J.T. Jr, Lasers Surg Med, 1988).
Enfin, les lasers CO2 de faible puissance (de l'ordre du milliwatt) sont utilisés dans l'anastomose du canal déférent dans le cadre d'une microchirurgie après vasectomie. ( Lynne C.M., Lasers Surg Med, 1983 ; Shanberg A., J Urol, 1990).
Le laser neodymium :yttrium-aluminium-garnet (YAG)
Son faisceau d'émission est d'une longueur de 1060 nm et il traverse mieux les tissus que le laser CO2 car l'eau absorbe moins son rayonnement. Un tissu bien en-dessous de la surface est donc atteint par le faisceau laser, les protéines de ses cellules en absorbent l'énergie et chauffent. Ce n'est qu'après un laps de temps relativement long que le tissu-cible atteint le point d'ébullition de l'eau et que l'évaporation débute. La zone de nécrose thermique peut être 100 fois plus épaisse qu' avec un laser CO2 de même puissance et la conséquence est une zone de coagulation thermique profonde qui laisse une cicatrice imposante.
Le laser Nd :YAG est plus aisé à adapter aux instruments endoscopiques car, d'une part, son faisceau peut être produit à travers des fibres quartz flexibles et fines, d'autre part, il peut être utilisé avec des fluides d'irrigation conventionnels tels que l'eau, les solutions salines et la glycine.
Le Nd :YAG laser a donc été utilisé pour approcher les tumeurs vésicales superficielles et les sténoses urétrales. Pour les premières, les avantages sur une cautérisation électrique sont la réduction du risque d'essaimage de cellules tumorales et l'accessibilité des tumeurs de la paroi antérieure ou du dôme vésical. Cependant, aucune étude n'a, à ce jour, démontré que le risque de récidive est plus faible avec le laser Nd :YAG qu'avec une électro-résection classique.
Le traitement des sténoses urétrales a été décrit par plusieurs auteurs (Dogra P.N., J Urol, 1999 ; Perkash I., J Urol, 1997 ; Hrebinko R., J Urol, 1996 ; Perkash I., J Urol, 1994 ; Anson K., Br J Urol, 1994 ; Vicente J., J Eur Urol, 1990 ; Smith J.A., J Urol, 1989 ; Bloiso G., Urol, 1988 ; Smith J.A., J Urol, 1984 ; Shanberg A.M., Urol, 1984) mais la profondeur de pénétration du faisceau dans le tissu amène fréquemment à des récidives.
Les condylomes et hémangiomes urétraux de même que les lésions carcinomateuses superficielles du périnée ou de la verge peuvent être approchées par le laser Nd :YAG. La profondeur de pénétration du faisceau constitue dans ces indications oncologiques un avantage que n'offre pas le laser CO2.
Il est à noter que le faisceau perd sa cohérence à la sortie de la fibre optique à cause du mécanisme de réflexion interne qui permet sa transmission à travers la fibre. L'inclinaison de cette dernière provoque également une perte de puissance du faisceau laser qui peut être compensée par l'utilisation de petits diamants qui concentrent l'énergie du faisceau à sa sortie et peuvent être appliqués directement sur la peau pour des utlisations de section essentiellement.
Le laser KTP
Le laser KTP 532 est un dérivé du laser Nd :YAG 1064 nm par l'adjonction d'un cristal de potassium titanyl phosphate à la sortie du système qui permet de doubler la fréquence et d'obtenir ainsi une longueur d'onde de 532 nm. Celle-ci correspond à la fréquence d'absorption des pigments tissulaires dont l'hémoglobine. La pénétration du faisceau étant très courte (de l'ordre de 1 à 2 mm), l'effet tissulaire, similaire à celui du laser argon, constiste en une vaporisation et moins une coagulation comme pour le laser Nd :YAG. Dès l'échauffement du tissu au-delà de 100°C, on assiste à la transformation de l'eau intracellulaire en vapeur. Les constituants cellulaires se volatilisent et il apparaît une ablation immédiate du tissu avec formation d'un cratère qui est entouré d'une zone de coagulation. Il évite ainsi le développement de tissu cicatriciel provenant d'une dévascularisation autour de la zone traitée et est particulièrement hémostatique dans son utilisation. (Schmidlin F., Annales d'Urologie, 1997 ; Turek P.J., Endourology, 1992 ; Shanberg A., Urology, 1988)
Le laser Holmium :YAG
Le laser holmium a une longueur d'onde de 2100 nm et fonctionne sur le mode pulsé. Comme son nom le suggère, son milieu actif est un élément terrestre rare, l'holmium, qui peut être combiné avec un cristal yttrium-aluminium-garnet (YAG) sous forme d'holmium :YAG (Ho :YAG) ou avec l'yttrium-scandium-gallium-garnet (Ho :YSGG). La durée des impulsions est de 250-350 microsec, l'énergie délivrée à chaque impulsion de 0.2-4.0 J/impulsion, la fréquence de 5-45 Hz et la puissance moyenne de 3.0-80 Watts. La longueur d'onde de 2100 nm est significativement absorbée par l'eau, de sorte que la majorité de l'énergie est absorbée à la surface tissulaire donnant une section ou une ablation superficielle. Le niveau de pénétration étant très faible (env. 0.05 mm), la ligne de section est très précise avec une zone restreinte de dommage thermique, la chaleur résiduelle permettant d'obtenir une certaine action hémostatique dans les tissus vascularisés. La longueur d'onde de l'holmium présente l'avantage de pouvoir être transmise le long de fibres optiques, permettant une utilisation endoscopique. (Johnson D.E., Lasers Surg Med, 1992 ; Erhard M.J., J Endourol, 1995 ; Razvi H.A., J Endourol, 1995)
Les propriétés tissulaires ablatives du laser holmium se retrouvent superficiellement avec une zone d'atteinte thermique de 0.5-1.0 nm., ce qui représente une atteinte 5 à 10 fois inférieure à celle du laser Nd :YAG et 10 à 15 fois supérieure à celle du laser CO2. L'ablation tissulaire peut être pratiquée à l'air libre ou endoscopiquement dans un milieu fluide dans un mode de contact ou sans contact direct avec le tissu.
Outre son effet ablatif sur le tissu, le laser holmium a un effet remarquable dans la fragmentation de calcul par des effets de chaleur et d'onde de choc combinés. (Yiu M.K., Lasers Surg Med, 1996 ; Grasso M., Urology, 1996)
Le laser à lampe flash
Ce laser pulsé est un laser à lampe flash récemment développé qui est utilisé essentiellement pour la fragmentation des calculs urétéraux par urétéroscopie. La lampe flash pompe son énergie d'activation dans le milieu actif, qui alors émet un rayonnement pendant le court laps de temps du flash, générant une impulsion d'énergie-laser qui dure 2 microsecondes. Malgré le peu d'énergie d'un flash (30-60 millijoules), le taux de libération d'énergie est élévé (15-30000 W/s) et est accru par la canalisation de cette énergie dans une fine fibre quartz. La densité de puissance de la fibre au contact du calcul est donc de 11900000 W/cmcarré pendant la durée d'une impulsion. Cette énergie entraîne des microexplosions et une onde de choc à la surface du calcul par la génération instantanée d'un plasma, provoquant la fracture du calcul le long de certaines surfaces de tension.
Le laser argon
Le laser argon produit un faisceau de 2 longueurs d'onde prédominantes : 488 et 514 nm dans la partie bleue-verte visible du champ magnétique. Sa lumière est fortement absorbée par l'oxyxhémoglobine et s'applique donc sélectivement aux structures vasculaires. La profondeur de pénétration dans le tissu est de 1mm. Le laser argon est transmis par des fibres de quartz et peut être utilisé dans l'eau. L'utilisation pour la coagulation de tumeurs vésicales et pour l'évaporation des sténoses urétrales est encourageante. Le laser argon est strictement limité dans son débit de puissance aux alentours de 15 W, d'où une difficulté d'abord des tumeurs vésicales de plus de 1 cm de diamètre. (Rothye C.F., Urology, 1980)
Laser et cicatrisation
Le laser a commencé à être utilisé au début des années 1980 pour le traitement des sténoses urétrales, essentiellement sous la forme du Nd:YAG laser. Son emploi était motivé par le taux élevé de récidive à la suite du traitement par urétrotomie interne à la lame froide. Les résultats décevants obtenus avec ce type de laser ont été expliqués entre autres par une possible coagulation excessive du tissu.
De nouveaux lasers tels que les lasers KTP 532 et Ho:YAG ayant fait leur apparition, leur emploi dans le traitement des sténoses a donné des résultats encourageants.
L'objectif visé par le traitement des rétrécissements de l'urètre est d'une part d'agrandir la lumière urétrale et d'autre part d'empêcher une récidive dans les semaines ou mois suivant l'intervention thérapeutique. L'urétrotomie interne à la lame froide satisfait partiellement à la première exigence en permettant l'incision du tissu sténotique et l'ouverture consécutive de l'urètre. Cependant, par cette simple incision du site de sténose, le tissu lésé va être le lieu d'un processus cicatriciel à partir du sillon pratiqué et évoluera selon une forte probabilité vers une rétraction physiologique amenant à un nouveau rétrécissement de la lumière urétrale et par conséquent à une récidive de la lésion initiale.
L'abord par laser apparaît plus prometteur parce qu'il a un effet biologique adapté aux exigences imposées par le caractère physiopathologique particulier des sténoses de l'urètre. Il faut en effet disposer d'un outil ou d'une méthode qui permette de se débarrasser de la véritable gangue que constitue le tissu sténotique et d'empêcher qu'il ne se reforme par la suite.
Tous les lasers ne permettant pas d'atteindre ces deux objectifs, il est évident que le choix du laser à utiliser se fait essentiellement en fonction de son action sur le tissu-cible. L'effet recherché est surtout l'effet de vaporisation car il permet de se débarrasser du tissu fibrotique et cicatriciel qui constitue véritablement la sténose.
Le laser le plus adapté pour cette tâche est incontestablement le laser CO2 car son effet de vaporisation est le plus important parmi tous les lasers. Cependant, l'énergie délivrée par une telle longueur se disperse rapidement dans un milieu fluide et aucun système de fibre ne permet à l'heure actuelle de l'employer par l'intermédiaire d'un endoscope. Le laser Argon dont la longueur d'onde est de 458-515 nm peut quant à lui être conduit à travers un endoscope dans un milieu liquide mais son utilisation a été très limitée pour l'instant dans le traitement des sténoses urétrales. (Laranne, J., Eur Arch Otorhinolaryngol., 1996)
Des expériences avec le laser Nd:YAG ont donné des résultats comparables à ceux de l'urétrotomie interne car son effet se caractérise par une coagulation prédominante et à une nécrose comparable à l'électrocoagulation qui aboutissent au développement d'une rétraction cicatricielle et à une récidive de la sténose. (De Sy, Ann Urol, 1993)
Le laser KTP 532 offre quelques avantages: premièrement, il a une action de vaporisation qui détruit le tissu fibreux et ne laisse en principe pas, au contraire de l'urétrotomie interne, de résidus tissulaires susceptibles de constituer le point de départ d'une éventuelle récidive. De plus, l'effet de vaporisation assure une hémostase précieuse dans la prévention de l'apparition de médiateurs de la réaction inflammatoire et du processus cicatriciel consécutif. Ceci est notamment dû à la longueur d'onde de 532 mm qui assure une affinité élevée pour l'hémoglobine et de ce fait une destruction vasculaire ciblée et efficace. Enfin, il est relativement aisément utilisé avec un endoscope et doit être appliqué sur toute la circonférence du tissu cicatriciel pour obtenir son ablation totale.
En ce qui concerne l'effet du laser sur le processus de cicatrisation proprement dit, différentes études tendent à développer certains points nécessaires à la compréhension sans cesse améliorée de l'effet bénéfique du laser pour empêcher ou favoriser le processus cicatrisation. Celles-ci sont d'ailleurs en majorité consacrées aux laser Nd:YAG et CO2 dont les effets commencent à être mieux expliqués. (De Sy, W.A., Ann Urol, 1993; Laranne, J., Eur Arch Otorhinolaryngol., 1996).
L'effet hémostatique du laser évite largement le saignement de la plaie, l'aggrégation plaquettaire ne se produit pas et les médiateurs actifs tels que le PDGF ne sont pas libérés. Celui-ci stimule entre autres la réplication cellulaire et constitue un des agents chimiotactiques les plus puissants. La réponse inflammatoire cellulaire est ainsi amoindrie et retardée, l'évacuation des débris cellulaires ralentie. Ainsi, le début de la néovascularisation est retardé par rapport à une lésion sanglante. (Dew., D.K., Lasers Orth Surg, 1993)
La formation du tissu de granulation dépend essentiellement de l'activité des fibroblastes qui produisent les composantes de la matrice extracellulaire. Leur migration et leur activité étant réduite à la suite d'une irradiation au laser, la formation d'un tissu de granulation est réduite et ralentie par rapport à une incision au scalpel. Selon certaines études, la formation de collagène se révèle diminuée, les fibres ne prenant pas une disposition en lignes usuelle. Le manque de fibronectine, l'un des principaux chémoattractants sécrété par les macrophages concourt également au peu d'ampleur de la réaction inflammatoire.
La rétraction cicatricielle se retrouve fortement diminuée voire inexistante selon certains auteurs par un nombre très restreint de myofibroblastes qui sont responsables de cette phase cicatricielle. (Schüncke, M., Adv Otorhinolaryngol, 1995; Thomsen, S., Photochemistry and Photobiology, 1991)
Enfin, la réépithélialisation, selon certaines études concordantes, semble retardée sans pour autant que son potentiel n'en soit affecté.
Ainsi, si les différentes recherches expérimentales ne peuvent pour l'heure élucider complètement l'effet réel du laser sur les tissus biologiques et par conséquent sur la cicatrisation, certaines pistes permettent de mieux comprendre les bénéfices que l'on peut attendre d'un traitement au laser des sténoses urétrales.
Etude sur le traitement au laser des sténoses urétrales
But
Il s'agit d'apprécier le taux de succès du traitement au laser de la sténose urétrale au minimum 2 ans après la thérapie.
Matériel et méthode
De décembre 1994 à mars 1998, 44 patients ont été traités au moyen du laser pour un problème de sténose urétrale à la clinique d'Urologie des HUG, après que le diagnostic eut été posé sur la base d'une anamnèse de dysurie confirmée par une débitmétrie pathologique et une cystourétrographie rétrograde. De ce collectif, 28 patients ont pu être reconvoqués dans le cadre de l'étude. Les 16 autres ont soit refusé de participer à l'étude, soit n'ont pas pu être retrouvés ou alors sont décédés depuis lors.
Chez 16 patients, il s'agissait d'une sténose récidivante.
Tous les patients ont été opérés en anesthésie générale ou en rachianesthésie sous prophylaxie antibiotique. La sténose a été cathétérisée au préalable par une sonde Charrière 5, afin de permettre un repérage exact de la sténose. Le rayon laser a été dirigé sous contrôle visuel par une fibre à tir direct d'un diamètre de 400 microm. La vaporisation de la sténose a été obtenue en maintenant la fibre au contact du tissu sténotique. Le laser a été utilisé avec une puissance de 10 à 15 Watts en mode continu. 2 types de laser ont été utilisés: le laser KTP chez 15 patients et le laser Ho:YAG chez 13 malades. Le choix du laser dépendait de la date opératoire puisque le premier type (KTP) a été utilisé jusqu'en mai 1997 et le second (Ho:YAG) à partir de juin de la même année. Le temps de contact de la fibre avec le tissu sténotique a été régulièrement interrompu après quelques secondes, afin de contrôler en permanence l'effet tissulaire. En fin d'intervention, une sonde Charrière 18 était laissée en place.
Les patients ont été revus de 21 à 53 mois post-opératoires (moyenne 33 mois). L'évaluation comprenait une anamnèse, un examen clinique, une débitmétrie et une mesure du résidu post-mictionnel. En cas de réapparition d'une dysurie, d'une débitmétrie pathologique ou de doute, le bilan était complété par une urétrographie rétrograde.
Les résultats ont été classifiés en quatre groupes (bon, moyen, mauvais, échec).
Un bon résultat correspond à une patient asymptomatique, avec un débit urinaire maximal de plus de 15 cc/s.
Un résultat moyen correspond à un patient asymptomatique, satisfait, avec une débitmétrie entre 8 et 15 cc/s.
Le patient redevenu symptomatique avec un débit urinaire maximal de moins de 8 cc/s ou avec une cystourétrographie mettant en évidence une sténose est considéré comme mauvais résultat.
Si le mauvais résultat nécessite une réintervention ou le passage à une autre forme de thérapie, le traitement est considéré comme un échec.
Globalement, les patients aux deux premières catégories (bon et moyen résultats) ont été évalués comme succès thérapeutique.
Résultats
Comme signalé auparavant, parmi les 44 patients opérés par laser à la clinique d'urologie entre décembre 1994 et mars 1998, 28 ont pu être pris en considération pour l'étude. Ceux-ci étaient âgés de 19 à 83 ans (moyenne 60,9 ans) au moment du traitement et 7 d'entre eux présentaient une double sténose, d'où le total de 35 sténoses.
L'étiologie était iatrogène (post-opératoire, sondage) dans 14 cas, infectieuse dans 3 cas, traumatique dans 1 cas et inconnue dans 10 cas.
 Fig. 10 : Etiologie des sténoses
Fig. 10 : Etiologie des sténoses
La localisation de la sténose était dans 27 cas (77%) bulbaire, dans 3 cas (9%) une anastomose vésico-urétrale, dans 5 cas (14%) l'urètre pénien. La longueur des sténoses était comprise entre 3 et 20 mm avec une moyenne de 10,6 mm.
 Fig. 11 : Localisation des sténoses
Fig. 11 : Localisation des sténoses
Le nombre de bons résultats est de 2 (7%), de résultats moyens de 4 (14%), de
mauvais résultats de 4 (14%) et d'échecs de 18 (60%).
 Fig. 12 : Résultats du traitement
Fig. 12 : Résultats du traitement
Parmi les patients dont le traitement est considéré comme un succès, on en retrouve 5 avec une sténose bulbaire, 1 avec une sténose pénienne, la longueur moyenne de la sténose étant de 12 mm.
Dans chaque groupe respectif, celle-ci était la suivante: 11,5 mm dans le groupe des bons résultats (2 patients), 10,4 mm dans celui des résultats moyens (4 patients), 12,8 mm dans celui des mauvais résultats (4 patients) et 12,6 mm dans celui des échecs (18 patients).
Dans le groupe traité par laser KTP (15 patients), on constate 3 résultats moyens, 3 mauvais résultats et 9 échecs. Dans celui traité par laser Ho:YAG (13 patients), on retrouve 2 bons résultats, 1 résultat moyen et 1 mauvais résultat de même que 9 échecs.
Parmi les échecs, 3 patients ont subi une réintervention au laser, 1 par urétrotomie au laser, 10 ont été réopérés à ciel ouvert et 4 bénéficient de dilatations itératives.
A la lumière de cas résultats, il semble difficile d'établir une corrélation entre l'étiologie, le degré ou la longueur de la sténose et le taux de récidive.
Discussion
Il faut tout d'abord prendre en considération le nombre relativement restreint de traitements (44) dans la période considérée et le nombre de patients qui ont pu être pris en compte dans le cadre de l'étude (28).
Il faut ensuite rappeler que cette étude reprend, pour une partie de son collectif, un groupe de 20 personnes traitées par laser entre décembre 1994 et décembre 1995. Ce travail, dont les conclusions se basaient sur 3 évaluations successives à 3 semaines, 3 mois et 6 mois post-opératoires, signalait un taux de succès thérapeutique de 81% à 6 mois.(Schmidlin F., Ann Urol, 1997)
L'étude présentée ici reprend ce même collectif élargi avec un minimum de 21 mois de recul et une moyenne de 33 mois post-opératoires.
Sur les 28 personnes que l'on prend en compte, on dénombre 2 bons résultats, 4 résultats moyens, 4 mauvais résultats et 16 échecs.
On doit observer d'une part que les 2 seuls bons résultats ont été obtenus avec le laser Ho:YAG, d'autre part que la méthologie souffre d'un biais dans la mesure où l'utilisation de l'un ou de l'autre laser ne se fait pas au hasard mais selon la date de l'intervention (avant juin 1997:laser KTP, après cette date Ho:YAG).
Le taux de succès avec un délai post-opératoire d'une année et demi au moins est de 21%. Ces résultats suggèrent une efficacité à long terme moindre par rapport à l'urétrotomie interne et surtout l'urétroplastie.
Quelles peuvent en être les raisons ?
Les lasers KTP et Ho :YAG présentent théoriquement des caractéristiques technique adaptées au traitement des sténoses urétrales. Leur principal intérêt réside dans l'action de vaporisation du tissu sténotique et dans la technique peu hémorragique qui permet en principe de limiter l'effet de cicatrisation.
Toutefois, cet effet de volatilisation tissulaire est certes responsable de la disparition immédiate du tissu sténotique mais demande d'une part que le faisceau soit précisément et uniquement appliqué sur la plaque fibro-cicatricielle, d'autre part qu'il soit bien en contact avec celle-ci pour que l'effet escompté soit obtenu.
En effet, la vaporisation nécessite un échauffement du tissu au-delà de 100 °C. Si l'irradiation se fait à une trop grande distance, le transfert d'énergie n'est pas optimal et l'on obtient surtout une coagulation tissulaire qui entraîne alors une processus cicatriciel important. Cependant, par cette technique, on contrôle mal la dose d'énergie délivrée et surtout la profondeur d'action thermique du faisceau laser qui est à même d'endommager le stroma sain sous-jacent et entraîner un nouveau remaniement cicatriciel important. Le succès thérapeutique de la méthode ne dépend pas seulement de l'habileté ou de l'expérience de l'opérateur mais aussi de la nature et de la morphologie du tissu sténotique.
De plus, si le mécanisme d'action et les effets à court terme du laser commencent à être bien connus, en particulier sur les tissus biologiques, les effets à long terme sont encore largement méconnus et n'ont pas encore fait l'objet de travaux décisifs tant au niveau expérimental que clinique. Les études publiées à ce jour tendent de plus en plus à démontrer que le laser semble davantage retarder le processus de cicatrisation que l'atténuer ou le supprimer. (Giffin, M., Ann Ac of Med, 1994; Jarmuske, M. B., B J of Plast Surg, 1990; Schünke, M., Adv Otorhinolaryngol., 1995)
Il semble d'autre part que la durée du suivi a une influence importante sur les résultats obtenus : les trois études publiées (Schmidlin, F., Ann Urol, 1997; Shanberg, A., Urology, 1988; Turek, Urology, 1992) avaient une durée d'évaluation post-opératoire de 6 à 16 mois alors que les résultats obtenus ici ont été récoltés en moyenne 33 mois après l'intervention.
Ensuite, on met en évidence une différence ténue entre l'efficacité des 2 types lasers en faveur du laser Ho:YAG dans ces indications thérapeutiques. On ne peut pas en tirer de conclusions définitives mais il pourrait s'agir d'un élément révélateur d'une supériorité de ce laser par rapport au laser KTP.
Enfin, il paraît clair qu'un collectif aussi restreint impose la plus grande prudence quant à l'interprétation des résultats.
Conclusion
A la lumière de ces résultats, on peut conclure que :
-
les résultats du traitement de la sténose urétrale par laser, prometteurs dans l'année post-opératoire, sont à plus long terme plus décevants que ceux de l'urétrotomie interne et surtout de l'urétroplastie.
-
il est difficile de poser clairement les indications strictes au traitement par laser, les sténoses courtes, uniques et non-récidivantes semblant présenter les meilleures chances de succès. De plus, il ne semble pas exister de corrélation entre la localisation de la sténose et la probabilité de réussite du traitement.
-
le traitement doit être impérativement pratiqué par un opérateur expérimenté, utilisant préférentiellement le laser Ho:YAG pour le traitement.
-
des études randomisées portant sur des collectifs plus conséquents pourront, à l'avenir, apporter plus de précisions sur ce sujet et amener à des conclusions affinées.
[Précédent]
[Suivant]