1. Introduction
1. Présentation de l'étude
La dépression majeure est une maladie handicapante associée avec une morbidité et mortalité significative. La maladie est souvent sous-diagnostiquée et sous-traitée, et son impact physique est souvent sous-estimé 1 .
Chez des patients hospitalisés pour dépression majeure et qui présentent souvent une forme sévère de dépression, l'intervention pharmacologique est initialement un élément très important de la prise en charge globale. Traiter au plus vite et avec le moins d'effets secondaires possibles ces états psychopathologiques est dans l'intérêt premier du patient et de son entourage, mais aussi, dans une certaine mesure, des institutions.
La Clinique de psychiatrie II du Département de psychiatrie recourait, en routine, à des traitements relativement homogènes des déprimés hospitalisés. Un tel contexte se prêtait particulièrement bien à l'accumulation de données descriptives sur les réponses au traitement dans des conditions dites naturalistes.
Objectifs :
Obtenir chez des patients dépressifs hospitalisés et traités dans les conditions usuelles, des données précises permettant de :
-
Rassembler des données préliminaires permettant d'élaborer de nouvelles hypothèses et/ou approches méthodologiques concernant la prédiction de la réponse au traitement et le délai optimal avant de décider de l'introduction d'un traitement potentialisateur.
-
Evaluer l'efficacité et la tolérance d'un traitement de première intention par venlafaxine à pleine dose (300 mg/j.).
-
Evaluer l'efficacité et la tolérance d'une addition de trazodone en cas de troubles du sommeil persistant en cours de traitement par venlafaxine.
-
Etudier les variations interindividuelles du métabolisme et l'existence d'un lien entre concentrations plasmatiques de venlafaxine et effet clinique, en prenant en compte les concentrations globales de venlafaxine (monitoring classique) et les concentrations des deux énantiomères qui la constituent (dosages stéréospécifiques).
2. La venlafaxine : description
La venlafaxine est un double inhibiteur spécifique de la sérotonine et de la noradrénaline avec une efficacité clinique prouvée 2 , 3 . Il pourrait être aussi efficace et mieux toléré que les classiques tricycliques 4 , 5 et aussi bien toléré et plus efficace que des inhibiteurs sélectifs de la sérotonine 6 , 7 eux-mêmes d'ailleurs suspects de ne pas toujours être aussi efficaces que les tricycliques 8 , en particulier dans les formes les plus sévères de dépressions 9 . Chez ces patients, une dose de venlafaxine de 75 à 375 mg/j administrés durant 6 semaines a été significativement plus efficace que le placebo, et au moins aussi efficace que l'imipramine, la clomipramine, la trazodone ou la fluoxetine 10 .
La venlafaxine a démontré aussi son intérêt dans le traitement de dépressions jugées résistantes sur des critères particulièrement stricts 11 . Elle serait efficace dans environ un tiers des patients avec une dépression résistante aux autres traitements. 12
A. Récepteurs
La dépression est souvent liée à des perturbations des voies neurochimiques de la sérotonine et de la norépinéphrine dans le cerveau. Les antidépresseurs ont ainsi été ciblés afin d'agir sur la neurotransmission noradrénergique et serotoninergique. Les différences entre les antidépresseurs peuvent être attribuées à leurs effets différant sur le blocage des récepteurs et la recapture des neurotransmetteurs. Les effets secondaires avec les antidépresseurs tricycliques peuvent par exemple être attribués directement au blocage des récepteurs muscariniques, histaminergiques et a1-adrénergiques 13 .
La venlafaxine (1-2- [dimethylamino] -1- [4-methoxy-phenyl] ethyl cyclohexanol, hydrochloride) agit en inhibant spécifiquement le recaptage de la sérotonine et de la norépinéphrine. Elle n'a pas d'affinité pour les récepteurs muscariniques cholinergiques, histaminergiques et adrénergiques, contraire-ment aux traitements tricycliques. Cinquante-six pour-cent de la dose de venlafaxine est métabolisée en une forme active, le O-Desmethylvenlafaxine, qui a un profil neuropharmacologique similaire à la venlafaxine.
L'action mixte peut être particulièrement importante pour le traitement des dépressions plus sévères, qui ont plus tendance a démontrer des altérations dans la transmission noradrénergique 14 . La venlafaxine et son métabolite actif ont tous deux des courtes demi vies. Elle a une courbe pharmacocinétique linéaire et une corrélation dose-réponse semi-linéaire entre des doses de 75 à 375 mg/j. Elle est faiblement liée aux protéines. Comparée à la classe des ISRS, la venlafaxine n'a que peu d'effets d'inhibition sur les isoenzymes du cytochrome P450 (1A2, 2C9, 2C19, 2D6 et 3A3/4), diminuant le risque d'une interaction pharmacocinétique avec d'autres médicaments.
La venlafaxine est un racémate composé en part égale de deux énantiomères, deux molécules qui ont la même formule plane mais des configurations dans l'espace à trois dimensions qui sont différentes avec une symétrie en miroir. Ces deux énantiomères ont des propriétés pharmacologiques différentes 15 .
B. Effets secondaires
Les effets indésirables du traitement par Efexor et Efexor ER comparés au placebo sont exposés dans l'annexe 1. Les plus courants sont des nausées, une somnolence, des céphalées et des vertiges.
Un grand nombre des effets secondaires survenant le plus fréquemment sont en rapport avec les doses administrées et sont observées surtout durant la première semaine de traitement. L'intensité et la fréquence des effets secondaires diminuent généralement au cours du traitement. L'incidence de nombre de ces effets indésirables est plus faible au cours du traitement par Efexor® ER capsules, utilisés dans cette étude, qu'au cours du traitement par Efexor® comprimés 16 . Il est à relever qu'une augmentation de la pression artérielle peut apparaître 17 particulièrement lorsque la venlafaxine est administrée à hautes doses 18 .
Comme pour les ISRS, la venlafaxine est généralement mieux tolérée que les antidépresseurs tricycliques. Elle ne semble pas affecter significativement la conduction cardiaque. Dans les études cliniques (données sur 19 études dans lesquelles 2181 patients ont reçu de la venlafaxine, 451 un placebo et 591 un antidépresseur de référence), la venlafaxine est considérée comme sûre et bien tolérée chez les patients avec une dépression majeure 19 .
3. La trazodone : association aux antidépresseurs
Les études épidémiologiques ont démontré qu'il y a une forte association entre les troubles du sommeil et la dépression. Près de 90% des patients dépressifs souffrent d'insomnie 20 . Un soulagement rapide de l'insomnie pourrait augmenter l'adhésion au traitement et améliorer les performances journalières ainsi que le fonctionnement en général, alors qu'un soulagement complet de l'insomnie améliorerait le pronostic 21 . Parfois, le trouble persiste de manière marquée, incitant à changer de traitement pour opter pour une molécule avec un profil d'action sédatif.
Les benzodiazépines sont encore fréquemment utilisés pour le traitement de l'insomnie dans la dépression. En raison du risque de tolérance et de dépendance ainsi que l'absence d'un effet antidépresseur propre, cette pratique ne peut être recommandée.
Pour résoudre ce problème avec les inhibiteurs sélectifs de la sérotonine, il a été proposé l'adjonction au coucher de trazodone, un antidépresseur sédatif habituellement bien toléré 22 .
La trazodone est un antidépresseur efficace 23 avec un mécanisme d'action proche de la néfazodone. Son principal métabolite, le m-chlorophénylpiperazine est un agoniste direct des récepteurs à 5-HT2C, ce qui expliquerait un effet anxiogène. La trazodone n'est pas anticholinergique mais elle antagonise les récepteurs histaminiques. Elle est faiblement antagoniste des récepteurs noradrénergiques alpha2 et fortement antagoniste des récepteurs alpha1. Elle est sédative et peut induire des hypotensions 24 .
Son activité thérapeutique pourrait être plus associée à son action post-synaptique anti-5HT2A et l'action agoniste post-synaptique 5-HT1 de son métabolite que sur sa faible inhibition de la recapture de la sérotonine 25 . Les antidépresseurs avec des propriétés préférentielles anti-5HT2 ont été décrits comme une bonne option thérapeutique des patients déprimés avec une insomnie marquée 26 .
Dans une étude comparative avec la trazodone et la venlafaxine 27 les deux médicaments étaient plus efficaces que le placebo, mais la venlafaxine a apporté une amélioration supérieure dans la perturbation cognitive et le ralentissement alors que la trazodone a amélioré les troubles du sommeil, évalués par l'échelle Hamilton de la dépression. Cette action positive sur les troubles du sommeil des patients déprimés a amené des auteurs à associer la trazodone à d'autres antidépresseurs, ISRS 28 , 29 ou IMAO 30 , 31 , 32 , qui ont un profil d'action moins favorable sur le sommeil.
Des doses de 200 à 400 mg par jour ont été proposées 33 . Cette pratique a été étendue dans notre clinique aux troubles du sommeil au cours de traitements par venlafaxine de façon satisfaisante.
4. Les patients dépressifs hospitalisés
A. Traitement et délai de réponse
En plus des coûts du traitement médicamenteux lui-même, ne représentant qu'environ 10% des coûts globaux de la dépression, on doit considérer les frais d'hospitalisation ainsi que les coûts indirects associés à la perte de productivité et aux comorbidités. Des comparaisons économiques entres différentes classes d'antidépresseurs ont souvent démontré que les antidépresseurs plus récents étaient plus rentables économiquement que les plus anciens en raison d'une tolérabilité ou efficacité accrue 34 .
Le délai d'action des antidépresseurs a une grande importance clinique. Les patients et les soignants ont tous deux besoin de savoir quand il faut s'attendre à un début d'amélioration. Les implications quant au confort de vie du patient et aux coûts de sa prise en charge sont d'une importance particulière en milieu hospitalier, la réduction d'un séjour hospitalier pouvant représenter à la fois une forte diminution des coûts directs et indirects.
Des études sur les antidépresseurs plus récents avec un double mode d'action, tels que la venlafaxine 35 , 36 et la mirtazapine 37 , suggèrent qu'ils auraient des débuts de réponse plus rapides. La venlafaxine serait plus rapide et plus efficace particulièrement à hautes doses 38 . Les traitements induisant un début de réponse rapide ont fréquemment une plus grande efficacité que ceux avec un début plus lent 39 . Pour d'autres auteurs, des études comparatives n'ont pas démontré un début d'amélioration plus rapide avec la venlafaxine que pour les antidépresseurs traditionnels 40 .
B. L'effet placebo
L'effet placebo doit être pris en compte dans l'évaluation à la fois de l'efficacité d'un antidépresseur et dans sa cinétique de réponse. Les attentes du patient face au traitement peuvent influencer la cinétique de réponse, en particulier les premiers jours.
Tout en étant habituellement favorables, les antidépresseurs placebo peuvent aussi induire des effets négatifs 41 . Les réponses positives au placebo sont hétérogènes : un placebo peut provoquer une amélioration abrupte ou graduelle qui peut être maintenue ou non. Une étude sur la réponse au placebo 42 chez des patients déprimés montre que les améliorations rapides sous placebo ont tendance à survenir plus tôt dans le traitement et à être moins persistantes que les améliorations progressives sous placebo. Plusieurs autres études 43 , 44 , 45 montrent que ce principe est également valable pour les médications actives : les améliorations précoces avaient moins tendance à persister. Elles ont suggéré que les améliorations rapides et soutenues avec des antidépresseurs pouvaient êtres dues à une réponse initiale au placebo suivie d'un réel effet pharmacologique.
Dans l'étude décrite ici, il n'est pas fait usage d'un placebo à titre de comparaison. L'effet du placebo sur un groupe contrôle ne pourra donc préciser l'intensité de cet effet sur la cinétique de réponse et le taux de réponse. Toutefois l'effet d'amplification d'un placebo inerte n'aurait pas permis de faire définitivement la part du placebo et de la molécule active. Dans l'effet d'amplification, un effet secondaire d'un médicament informe inconsciemment le patient qu'il reçoit une substance active sensée l'aider et mobilise une amélioration, induisant un biais dans leurs observations 46 .
Le cadre rassurant, soutenant et selon le cas structurant du milieu intra-hospitalier apporte un soulagement parfois rapide de la symptomatologie - certains patients dépressifs ont montré une amélioration significative avant l'introduction de tout traitement pharmacologique. Dans certains cas, l'amplitude de l'effet placebo peut dépendre de l'enthousiasme du thérapeute 47 . Finalement, une rémission spontanée de la maladie peut avoir lieu avant l'effet pharmacologique du traitement, particulièrement si les patients sont traités très tôt ou très tard dans le cours de leur épisode dépressif 48 .
5. La cinétique de réponse aux antidépresseurs
A. Définition et échelles
La réponse au traitement est définie ici comme étant une baisse de 50% ou plus du score évaluant la sévérité de la dépression, par rapport à la première évaluation. Plusieurs centaines d'articles contiennent de l'information spécifique concernant la réponse à des traitements antidépresseurs, mais des échelles très variées ont été utilisées. Les échelles utilisées en prédominance sont la Hamilton Depression Rating Scale (HAM-D) 49 , la Clinical Global Impressions Scale (CGI) 50 et la Montgomery Asberg Depression Rating Scale (MADRS) 51 . Malheureusement les termes anglais « fast onset » et « responder » avaient souvent des significations différentes pour différents auteurs au cours du temps 52 .
Dans cette étude, l'utilisation du score MADRS a été choisi, en particulier pour sa sensibilité au changement ainsi que sa facilité et rapidité d'utilisation. Une version traduite 53 avec un entretien standardisé d'après Corruble et Guelfi (1997), dernière adaptation mars 2000 adapté par G. Bertschy, S. Favre, S. Mohr et Ch. Osiek a été retenue.
L'évaluation était basée sur un entretien structuré abordant d'une part des questions générales sur les symptômes et d'autre part des questions détaillées permettant une évaluation précise de leur sévérité. L'évaluation portait sur l'état du patient depuis la dernière évaluation, ou sinon la semaine précédente.
La cinétique de réponse considère l'évolution des répondeurs au cours du temps. Dans certaines études décrites ci-dessous, l'évolution des patients présentant une amélioration a été considérée, l'amélioration étant définie comme étant une baisse d'un certain taux du score évaluant la sévérité de la dépression. L'amélioration pouvait être décrite en considérant si celle-ci était maintenue ou non d'une évaluation à l'autre.
B. Données de la littérature
Une étude portant sur des patients ambulatoires et évaluant le délai d'action pour une réponse avec de la fluoxétine 54 suggère que plus de la moitié des répondeurs à 8 semaines ont déjà un début de réponse à la deuxième semaine. Dans ce cas, le début de réponse à été défini par une baisse de 30% sur l'échelle HAMD-17, persistant et menant à une baisse de 50% à la semaine 8. Près de 75% des répondeurs avaient un début de réponse à 4 semaines. Inversement, l'absence de début de réponse entre les semaines 4-6 était associé à une probabilité de 73%-88% que les patients ne soient pas répondeurs à la huitième semaine.
Une revue récente de la littérature 55 estime que l'efficacité des antidépresseurs chez les patients avec une dépression sévère est d'environ 70%. Elle relève qu'il n'existe actuellement aucune étude prospective comparant adéquatement les antidépresseurs quant à leur délai d'action. Toutefois, quelques éléments suggèrent que certains antidépresseurs pourraient induire une réponse plus rapide que d'autres.
Cinq études portant sur 752 patients comparant divers antidépresseurs, la fluoxétine, la paroxétine le citalopram et la mirtazapine 56 démontrent les taux suivants de début de réponse (amélioration sur l'échelle CGI persistant à la sixième semaine) :
| Semaine 1 |
5 - 17 % |
| Semaine 2 |
16 - 25 % |
| Semaine 3 |
12 - 28 % |
| Semaine 4 |
9 - 15 % |
| Semaine 6 |
7 - 12 % |
Le total de répondeurs (baisse de plus de 50% sur l'échelle HAMD ou MADRS) à la semaine 6 a varié de 46 à 88 %.
Une étude multicentrique sur 274 patients suggère qu'une amélioration (ici baisse du score HAMD-17 ³ 20%) rapide sous mirtazapine ou paroxétine prédit une réponse stable (baisse du score HAMD-17 ³ 50% à semaines 4 et 6) avec une haute sensibilité chez les patients atteints de dépression majeure 57 :
| Sensibilité, spécificité, valeur prédictive positive (VPP), valeur prédictive négative (VPN) (%) de l'amélioration en tant que prédiction d'une réponse stable avec la mirtazapine (MIR) et la paroxétine (PAR) : |
| |
Sensibilité |
Spécificité |
VPP |
VPN |
| |
MIR , PAR |
MIR , PAR |
MIR , PAR |
MIR , PAR |
| Semaine 1 |
79 , 65 |
73 , 67 |
75 , 56 |
77 , 75 |
| Semaine 2 |
97 , 91 |
53 , 50 |
69 , 54 |
94 , 89 |
| Semaine 3 |
100 , 98 |
42 , 36 |
64 , 49 |
100 , 96 |
| Semaine 4 |
100 , 100 |
35 , 30 |
62 , 48 |
100 , 100 |
La venlafaxine a montré des différences statistiquement significatives par rapport au placebo dès le jour 4 dans une étude portant sur des patients hospitalisés sévèrement déprimés avec mélancolie 58 , et dès la semaine 1 dans une étude portant sur des patients ambulatoires avec une dépression majeure 59 . Une revue 60 relève que la venlafaxine, le citalopram et la mirtazapine ont des différences favorables statistiquement significatives quant à la réponse au cours des deux premières semaines, en comparaison à la fois avec le placebo et d'autres antidépresseurs. Selon cette revue, ce résultat serait probablement en lien avec un délai d'action plus court.
2. Méthode
1. Plan de l'étude
Il s'agissait d'une étude ouverte avec un bras principal correspondant au traitement par venlafaxine 300 mg/j. pendant 4 semaines.
Un bras accessoire correspondait aux cas de troubles du sommeil sévères résistant aux comédications permises et qui auraient justifié une sortie du protocole. Dans ce cas, une adjonction de trazodone était effectuée, le plan de traitement restant le même par ailleurs. La trazodone étant un antidépresseur de tels cas constituaient une cohorte de patients dont les résultats étaient évalués à part. L'introduction de trazodone se faisait dans la phase entre J7 et J21, dans la mesure du possible à J14.
2. Durée de l'étude
Après inclusion dans l'étude, la durée de participation était de 4 semaines, que les patients soient avec ou sans adjonction de trazodone.
L'étude s'est déroulée initialement en milieu hospitalier, mais elle était poursuivie en ambulatoire dans les cas où la réponse au traitement était telle que la sortie était possible.
3. Nombre de patients
Cinquante patients ont été inclus dans l'étude. Un nombre de 42 patients a terminé l'étude à J28. Parmi ceux-ci, 27 ont bénéficié du traitement de venlafaxine seul et 15 du traitement associant la venlafaxine et la trazodone.
4. Critères d'inclusion
Pour être inclus dans l'étude un patient devait remplir tous les critères suivants :
-
avoir un âge compris entre18 et 65 ans
-
être hospitalisé pour un épisode dépressif moyen ou sévère selon la classification CIM-10, sans caractéristiques psychotiques
-
avoir un score minimal de 25 sur l'échelle MADRS (Montgomery and Asberg Depression Rating Scale)
-
chez les femmes en âge de procréer, avoir reçu une information sur la nécessité d'une contraception (en particulier par rapport au lithium)
-
avoir accepté et signé le consentement éclairé
5. Critères d'exclusion
La présence de l'un ou l'autre des éléments suivants contre-indiquait la participation à l'étude :
-
la présence d'une affection organique en particulier cardio-vasculaire, rénale, hépatique ou cérébrale contre-indiquant l'utilisation de venlafaxine, trazodone ou lithium
-
une grossesse
-
la présence d'un diagnostic de schizophrénie ou de trouble schizo-affectif
-
la présence de caractéristiques psychotiques (congruentes ou non congruentes à l'humeur)
-
une dépendance à l'alcool, aux drogues ou à des doses supra-thérapeutiques (du point de vue de l'investigateur) de benzodiazépines selon les critères de la CIM-10, dans l'année précédente
-
une hypersensibilité connue à la venlafaxine, trazodone, ou lithium
-
l'échec d'un traitement antérieur avec venlafaxine ³ 225 mg/j
-
un traitement par IMAO dans les 2 semaines précédentes
-
un traitement en cours par thymorégulateurs ou neuroleptiques (un neuroleptique sédatif à faible dose, s'il pouvait être arrêté d'emblée ne contre-indiquait pas l'inclusion dans l'étude)
6. Organisation du traitement
A. La venlafaxine
Les patients étaient inclus dans l'étude dès que les conditions cliniques et éthiques étaient réunies. En pratique, cela représentait un minimum de 24 heures.
Lorsque le patient suivait déjà un traitement antidépresseur et qu'il était indiqué de modifier ce traitement dans le cadre du projet d'hospitalisation, un temps de sevrage initial était prévu. En fonction des connaissances actuelles 61 et de l'expérience pratique, un arrêt progressif ne doit pas être envisagé pour les inhibiteurs sélectifs de la recapture de la sérotonine mais doit l'être pour les antidépresseurs tricycliques, d'autant plus long (laissé à l'appréciation du clinicien) que la dose est élevée et le traitement de longue date. La première dose de venlafaxine était donnée dès le lendemain de la dernière dose de l'autre antidépresseur. Ce jour correspondait à J0.
| Le plan posologique |
| |
Matin |
Soir |
| J0 |
- |
75 mg |
| J1 |
75 mg |
75 mg |
| J2 |
150 mg |
75 mg |
| J3 et suivants |
150 mg |
150 mg |
Le plan posologique était un plan fixe. Une augmentation rapide des doses est en général bien tolérée 62 . Mais le clinicien responsable du traitement pouvait à tout moment réduire cette posologie si il observait chez le patient des éléments lui permettant de considérer la posologie comme excessive (ces éléments devaient être notifiés). Dans le cas de nausées en début de traitement, en première intention était proposé un étalement en quatre prises par jour et un traitement symptomatique par cisapride, 20 mg matin et soir, qui a été proposé dans cette indication 63 .
Un prélèvement pour dosage de venlafaxine était réalisé à J14, 12 heures après la dernière prise de la veille.
B. Comédications et gestion des risques et de l'inconfort
Pour le confort du patient et parce que l'angoisse et l'insomnie sont de nature à favoriser un passage à l'acte suicidaire, des comédications anxiolytiques et sédatives peuvent être utilisées selon les nécessités de la situation, même en pratique clinique. Par souci d'homogénéité des traitements, les mêmes substances ont été utilisées dans cette étude :
-
anxiété (et insomnie) : clorazepate (Tranxilium®), maximum 60 mg/j.
-
insomnie : zopiclone (Imovane®), maximum 15 mg/j.
Dans les cas extrêmes d'angoisse et de risque suicidaire, de la lévomepromazine (Nozinan®) pouvait être prescrite transitoirement. Si elle devait être donnée plus de 3 jours, le patient était exclu de l'étude. Une attention particulière était portée au risque d'hypotension en cas de co-prescription de trazodone.
Le risque suicidaire ne représentait pas en soi un critère d'exclusion (sauf s'il s'associait à des caractéristiques psychotiques), le traitement étudié se déroulant dans les conditions usuelles dans lesquelles sont traités des patients à risque suicidaire. Toutes les mesures de surveillance ont été donc prises comme habituellement.
Les patients ont bénéficié d'une thérapie de soutien individuelle et institutionnelle comme dans les conditions habituelles.
C. La trazodone
Si malgré l'usage de sédatifs et d'hypnotiques, un patient présentait un trouble du sommeil important et persistant (la recommandation était un score ³ 4 à l'item « réduction du sommeil » de la MADRS à toutes les évaluations pendant une période de 8 jours consécutifs) de nature à remettre en cause le choix de la venlafaxine en faveur d'un antidépresseur sédatif, le patient quittait le bras principal de l'étude pour le bras accessoire qui prévoyait la prescription de trazodone. Quinze patients ont rejoint ce bras accessoire.
Le changement devait être effectué lorsque possible à J14, en tout cas un jour d'évaluation après au moins 7 jours de traitement, et si possible avant 21 jours.
La posologie était de 50 mg en une prise au coucher, augmentée par paliers de 50 mg/j. jusqu'à obtention d'une réponse satisfaisante et en fonction de la tolérance.
7. Evaluation de départ
A J-1 et les jours précédents, les éléments nécessaires à l'inclusion (critères d'inclusion et d'exclusion) ont été recueillis ainsi que les éléments suivants :
-
un status somatique avec signes vitaux (pouls, TA couché-debout)
-
le diagnostic CIM-10 à 5 chiffres
-
la liste des traitements reçus pour l'épisode actuel
A J-1 et les jours précédents, les examens complémentaires suivants ont été réalisés : ionogramme, urée-créatinine, TSH-T4L, ECG, sédiment urinaire.
A J0, a été réalisée une évaluation MADRS.
8. Evaluation clinique
Chaque évaluation comprenait :
-
une évaluation MADRS (Montgomery and Asberg Depression Rating Scale) réalisée par un cotateur entraîné
-
le relevé, le cas échéant, de la date d'une amélioration ressentie par le patient (cette question tombait une fois l'amélioration survenue)
-
le relevé des effets secondaires mentionnés par le patient suite à une question ouverte à ce sujet
-
le relevé des comédications reçues depuis le jour de la dernière évaluation (inclus) jusqu'au jour de cette nouvelle évaluation (non inclus)
Les évaluations ont été réalisées à : J0 - J4 - J7 - J11 - J14 - J21 - J28.
Le choix d'une observation bi-hebdomadaire pendant les 2 premières semaines était motivé par l'objectif de repérer finement dans le temps une réponse qui pouvait être présente précocement.
Les patients étaient, par ailleurs, au bénéfice de l'évaluation clinique médicale et infirmière habituelle indépendamment de l'évaluation de la recherche.
9. Ethique
L'étude a été conduite en conformité avec les recommandations de la déclaration d'Helsinki et après approbation de la Commission d'Ethique du Département de psychiatrie de Genève. Un consentement éclairé écrit a été obtenu de chaque patient avant son inclusion dans l'étude.
La confidentialité des données a été garantie par une anonymisation des dossiers de recherche (un registre nominal des participants à la recherche étant tenu par l'investigateur principal).
4. Discussion et conclusions
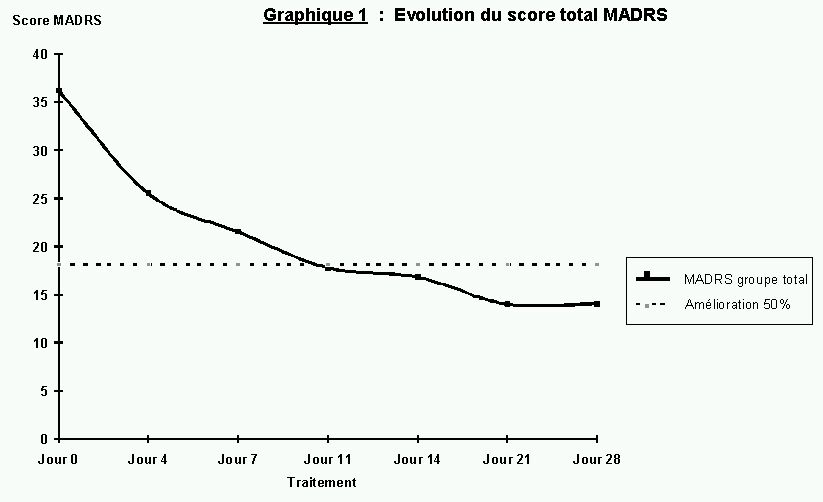
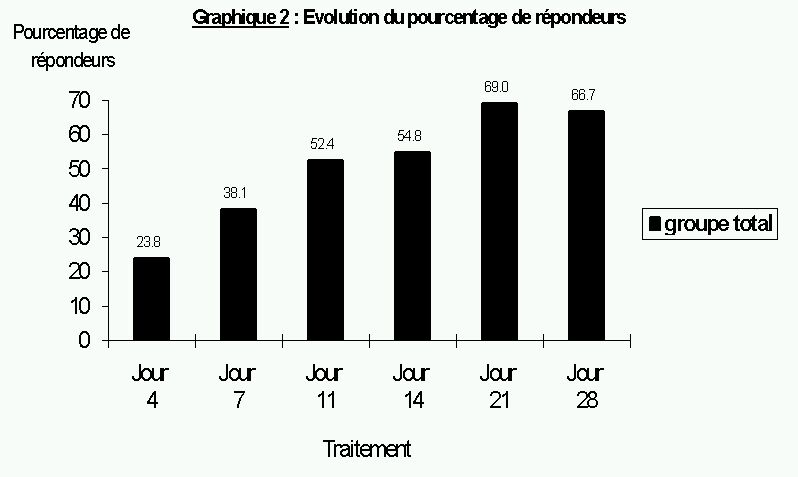
Dans cette étude, le traitement de la dépression par venlafaxine à doses élevées et trazodone a été efficace et bien toléré. Sur les 42 patients ayant terminé le protocole après quatre semaines 67% ont répondu favorablement, soit avec une amélioration du score MADRS de plus de 50%. Ce taux de réponse est comparable au taux de 70% d'efficacité des antidépresseurs chez les patients avec une dépression sévère, cité dans une revue de la littérature 64 . Il correspond également aux résultats d'une revue évaluant spécifiquement la venlafaxine face au placebo 65 .
Un tiers des patients ayant terminé l'étude recevaient un autre traitement antidépresseur dans les jours précédant leur inclusion, nous permettant de considérer qu'ils étaient partiellement résistants. L'effet malgré tout positif de la venlafaxine chez ces patients pourrait s'expliquer par le double mode d'action d'inhibition de la recapture de la sérotonine et de la noradrénaline, particulièrement à doses élevées pour cette dernière 66 , telles que celles administrées dans l'étude : la dose de 300 mg par jour est particulièrement adaptée au traitement des patients hospitalisés ou pour les cas résistant au traitement 67 .
Aucun patient n'a été exclu en début d'étude ou a dû bénéficier d'une réduction ou d'un étalement de la posologie pendant les premiers jours de traitement, y compris pendant la phase de titration rapide. Seul un patient a quitté celle-ci en raison d'un probable effet secondaire, une insomnie sévère. Un trouble du sommeil était toutefois déjà présent chez ce patient à son admission. La bonne tolérance à la venlafaxine a été soulignée dans la littérature 68 .
L'incidence d'effets secondaires attendus, tels que nausées, maux de tête et insomnie, a donc été particulièrement faible dans cette étude, malgré l'introduction rapide de la venlafaxine. Elle pourrait être liée à l'utilisation de sa forme retard, à libération prolongée du principe actif par microsphères encapsulées (Extended Release - ER). Des études ont démontré que le maintien de taux plasmatiques plus stables avec cette formule augmente la tolérance à la venlafaxine 69 , 70 .
Près d'un quart des patients (23.8%) avaient répondu au traitement quatre jours après l'admission. Les données de la littérature nous permettent d'exclure l'effet direct de la venlafaxine : le début d'une réponse thérapeutique liée aux traitements antidépresseurs seuls nécessiterait une administration continue d'au moins une semaine 71 . La réponse rapide dès quatre jours est un probable reflet du cumul de l'amélioration liée à l'antidépresseur, de la réponse clinique aux traitements anxiolytique (clorazépate) et somnifère (zopiclone), à l'effet placebo de l'administration d'un traitement, ainsi qu'aux bénéfices de la prise en charge hospitalière et de son cadre rassurant. Toutefois il est important de considérer la contribution d'un effet précoce de la venlafaxine, car une étude portant sur la venlafaxine comparée au placebo 72 démontre qu'une amélioration du score MADRS peut en effet être significativement supérieure avec la venlafaxine dès le quatrième jour. Dans cette étude, la venlafaxine avait également été instaurée par titration rapide jusqu'à des doses élevées.
Le pourcentage d'amélioration sur l'échelle de la dépression ne diffère pas significativement après quatre semaines de traitement maximal de celui observé après trois semaines. Ce résultat suggère qu'il serait possible d'identifier les sujets répondeurs et donc prévoir une adaptation du traitement chez les autres (par exemple avec une adjonction) déjà après trois semaines, avec une sensibilité et spécificité de ce test de 96% et 87% respectivement.
Dans une deuxième partie de cette étude, qui ne fait pas partie de ce travail de thèse, une potentialisation par lithium après la quatrième semaine a été planifiée, celle-ci ayant démontré son efficacité lorsqu'introduite chez des patients résistants à différents antidépresseurs 73 , 74 , 75 . Une étude sur l'adjonction de lithium dès le début d'un traitement antidépresseur de désipramine, en dehors d'une résistance avérée 76 , n'a pas démontré d'amélioration significative liée au lithium par rapport à l'antidépresseur seul. Les effets secondaires étaient par contre plus marqués.
Nos résultats suggèrent donc la possibilité de considérer l'introduction de lithium après trois semaines. Il serait ainsi intéressant d'évaluer dans une étude prospective l'efficacité d'une potentialisation versus placebo en cas de non-réponse à un moment donné, par exemple au jour 21 comme suggéré ci-dessus. L'évaluation de la potentialisation ne serait dans ce cas pas diluée par les patients répondeurs à l'antidépresseur seul en cas de potentialisation trop précoce. Un délai trop long avant cette potentialisation pourrait être évité en effectuant l'adjonction dès que les scores d'évaluation nous permettent de prédire avec une bonne sensibilité et spécificité que le patient est résistant au traitement.
Au moment de l'introduction de la trazodone, les patients ayant reçu celle-ci présentaient des troubles du sommeil plus marqués (item 4 de l'échelle MADRS) que ceux ne la recevant pas, justifiant par ailleurs leur orientation vers ce groupe, ainsi qu'une anxiété plus élevée (item 3) alors même qu'ils ne présentaient aucune différence sur les variables cliniques à l'entrée dans l'étude.
Sur les 15 patients traités par adjonction de trazodone en raison des troubles du sommeil, une amélioration du sommeil a été apportée, avec une disparition de la différence intergroupe de l'item 4 à quatre semaines de traitement. La prescription somnifère de zopiclone n'a pas été supérieure dans ce groupe. Une prescription de trazodone pourrait donc probablement se substituer efficacement à celle de benzodiazépines à visée somnifère. Ce résultat confirme ceux d'études dans lesquelles les troubles du sommeil ont été traités par adjonction de trazodone à d'autres antidépresseurs potentiellement stimulants tels que les SSRI 77 ou IMAO 78 . On notera que dans notre étude la trazodone était introduite en seconde intention lorsque la zopiclone ne suffisait pas. Il pourrait être intéressant de la tester en première intention.
Une amélioration de la tension intérieure n'a par contre pas été apportée par la trazodone. La tension interne est restée plus élevée dans le groupe traité par celle-ci à la fin de l'étude, malgré une consommation d'anxiolytiques sous forme de clorazépate de plus du double. Il est possible que la venlafaxine à une dose de 300 mg par jour soit trop activatrice pour un sous-groupe de patients, l'insomnie et la nervosité pouvant être des effets secondaires liés à la venlafaxine 79 . Il est également possible que la trazodone ait contribué à cet effet. Ayant une demi-vie courte et étant administrée au coucher, elle pourrait contrecarrer l'effet stimulant de la venlafaxine la nuit mais pas la journée, apportant ainsi un effet sédatif améliorant le sommeil, mais sans activité anxiolytique la journée.
La trazodone serait ainsi un traitement efficace et sûr chez les patients avec un trouble du sommeil résistant aux hypnotiques sous des doses élevées de venlafaxine, Nos observations suggèrent également que l'insomnie pourrait être associée à la tension intérieure et l'anxiété, l'administration de la trazodone au coucher n'étant pas utile dans le soulagement de ces symptômes la journée. Une étude randomisée pourrait mieux évaluer le lien entre l'insomnie et la tension intérieure-anxiété.
Au total cette étude a permis de confirmer l'efficacité et la bonne tolérance de la venlafaxine prescrite à haute dose selon un protocole de titration rapide, en intra-hospitalier. Elle suggère que trois semaines est un délai suffisant pour juger de l'efficacité du traitement et que l'adjonction de trazodone est une approche intéressante de l'insomnie.