Introduction
Les éventrations post-opératoires constituent de longue date un sujet de préoccupation. Elles représentent sans doute la complication tardive la plus fréquente de la chirurgie abdominale, survenant après 10% des laparotomies. Inesthétiques, gênantes, parfois douloureuses, voire dangereuses, elles sont grevées d'une morbidité non négligeable.
Pendant plus d'un demi-siècle, l'intérêt des chirurgiens était centré essentiellement sur des troubles locaux, à savoir fermer la brèche d'éventration, soit par suture directe, soit en sectionnant le feuillet antérieur de la gaine des droits pour le suturer au bord interne de l'autre côté. Avec ces deux techniques, le taux de récidive est fréquent, compris entre 20 et 50 % selon les études.
Mais la chirurgie des éventrations a évolué avec la reconnaissance du phénomène de « perte de substance » et l'évaluation des troubles physiologiques que cette complication entraîne. C'est pourquoi de nombreux chirurgiens, depuis l'arrivée sur le marché de matériaux prothétiques inertes il y a une trentaine d'années, ont choisi d'opérer certaines éventrations par l'incorporation d'un « filet » non résorbable, en comptant sur l'importante fibrose qu'il induit pour renforcer la paroi.
A l'Hôpital de La Gruyère, depuis plus de dix ans, la grande majorité des éventrations sont opérées par mise en place d'un filet de Mersilène® en position prépéritonéale.
Comme nous disposons d'un recul acceptable, que toutes les interventions ont été réalisées par le même opérateur, que la technique et le matériel n'ont pas changé au fil des années, nous avons pensé qu'un travail rétrospectif pourrait donner des conclusions intéressantes. Pour notre étude, nous disposons d'un collectif de 50 patients que nous avons pu presque tous revoir pour examen clinique et catamnèse.
Les hernies de la ligne médiane
Généralités
Dans notre manière d'aborder l'éventration et son traitement avec un renforcement prothétique, nous avons inclus les récidives de cure non prothétiques de hernie ombilicale et de hernie de la ligne blanche que nous avons ajoutées à notre collectif de cas. En effet, les hernies de la ligne médiane s'apparentent à l'éventration par le fait que la paroi est ouverte lors de la cure primaire et qu'une récidive à l'endroit de la cure a les mêmes caractéristiques qu'une « hernie cicatricielle ». Par ailleurs, nos indications à renforcer la paroi par un filet sont les mêmes pour l'éventration, que pour les récidives des hernies de la ligne médiane.
Avant d'aborder l'éventration à proprement parler, nous allons faire un petit rappel anatomopathologique des hernies de la ligne médiane. Nous traiterons la hernie ombilicale et la hernie de la ligne blanche.
La hernie ombilicale
La hernie ombilicale peut être classée en quatre types :
-
La hernie ombilicale de l'enfant
-
La hernie ombilicale acquise
-
La hernie paraombilicale
-
La hernie ombilicale de l'adulte
Nous n'insisterons pas sur les deux premières.
En effet, les hernies ombilicales de l'enfant ne se développent pas sur un terrain de faiblesse. Elles sont de type « malformatif », touchent un nouveau-né sur cinq, et régressent le plus souvent spontanément. En cas de persistance de la hernie, on peut proposer aux parents, suivant la taille du collet, une fermeture simple de l'anneau ombilical vers l'âge de cinq ans avec un risque minime de récidive.
Les hernies ombilicales acquises sont le résultat d'une augmentation de la pression intra-abdominale. Elles sont fréquentes chez les patients souffrant d'ascite, dans les cas de cirrhose, d'insuffisance cardiaque congestive ou encore d'insuffisance rénale. Dans de tels cas, l'abstention chirurgicale est de règle jusqu'à ce que la production d'ascite soit contrôlée. On voit alors très souvent une disparition spontanée de la hernie, de sorte que l'opération devient inutile. Une cure en urgence, en cas d'étranglement de la hernie, se solde par un taux élevé de récidives.
Dans ces deux conditions, la faiblesse pariétale n'est pas la cause primaire de la hernie et une cure classique (sans renforcement prothétique) en première intention est de règle. La mise en place d'un filet peut se discuter si le patient présente une faiblesse de paroi évidente.
La hernie paraombilicale
Une altération de la ligne blanche et du fascia ombilical (extension du fascia transversalis) sont à l'origine de la hernie paraombilicale. Ces dernières se localisent au niveau de la ligne blanche supra-ombilicale, bien qu'on puisse la trouver en dessous de l'ombilic. Les patients se plaignent souvent de douleurs abdominales intermittentes en relation avec un étranglement du sac herniaire. Dans la hernie paraombilicale, la moitié du sac est recouvert par l'ombilic, et le reste, juste par la peau adjacente à l'ombilic, contrairement à la hernie ombilicale, où la protrusion herniaire est exactement en regard de l'ombilic. Les hernies paraombilicales sont en quelque sorte à la frontière entre les hernies de la ligne blanche et les hernies ombilicales. Ce type de hernie se complique fréquemment d'étranglements du sac herniaire, raison pour laquelle il est de règle de les opérer.
La hernie ombilicale de l'adulte :
Beaucoup d'études ont été faites à ce sujet. Les uns pensent qu'il s'agit d'une persistance d'une hernie ombilicale de l'enfant, d'autres affirment qu'il n'y a pas de relation. On admet actuellement que seulement un patient adulte sur dix porteur d'une hernie ombilicale en avait présenté une dans l'enfance. Contrairement à la hernie de l'enfant, qui est de type direct, les hernies ombilicales de l'adulte sont de type indirect. Elles s'insinuent à travers le canal ombilical qui est bordé postérieurement par le fascia paraombilical, antérieurement par la ligne blanche et latéralement par les bords internes des muscles droits de l'abdomen. On trouve ce type de hernie le plus souvent (90%) chez la femme obèse et multipare. La hernie ombilicale de l'adulte a quatorze fois plus de chance de s'incarcérer que les hernies de l'enfant. Le grand épiploon est l'hôte le plus commun du sac herniaire et se fixe souvent par des adhérences aux parois du sac. La hernie est alors partiellement réductible, et s'accompagne de douleurs abdominales crampiformes en relation avec des épisodes d'étranglement intermittent. Elle s'associe fréquemment à des symptômes gastro-intestinaux, à cause des tractions qu'exerce le grand épiploon sur l'estomac et le colon transverse. La cure chirurgicale, surtout pour les hernies de grande taille, est nécessaire.
Nous n'aborderons pas dans ce chapitre la technique chirurgicale habituelle de la cure de hernie ombilicale. En revanche, il faut savoir que la récidive est fréquente et que dans ces conditions, à notre avis, une cure avec renforcement prothétique selon la technique décrite plus loin pour l'éventration est indispensable.
La hernie de la ligne blanche
On appelle communément hernies de la ligne blanche, voire hernies épigastriques si elles sont situées dans la région épigastrique les hernies localisées sur la ligne médiane. Elles siègent le plus souvent entre l'appendice xiphoïde et l'ombilic.
Historiquement intéressantes, ce sont les premières qui ont permis de comprendre les relations anatomo-fonctionnelles de la paroi abdominale. En effet, dans une revue allemande datant de 1909 (Capelle), on trouve un travail portant sur 31 cas de cure de hernie de la ligne blanche. Dans le suivi, 12 ont continué à présenter une symptomatologie douloureuse de type gastrique, 6 ont présenté une récidive, et surtout 4 sont morts de carcinome gastrique. Le lien entre la hernie de la ligne blanche et une pathologie intra-abdominale sous-jacente était fait. Dès lors, la hernie de la ligne blanche est devenue une entité clinique, s'accompagnant d'une symptomatologie abdominale très variée, souvent indépendante de la hernie, obligeant le médecin à procéder à des investigations abdominales complètes. Certains ont même proposé de pratiquer une exploration abdominale lors de la cure chirurgicale.
L'incidence de la hernie de la ligne blanche est difficile à évaluer car seule une sur quatre est symptomatique. Sur un collectif de patients autopsiés, on évalue sa prévalence dans la population générale entre 0,5% et 10%. C'est une pathologie presque exclusive de l'adulte, avec une nette prédominance pour le mâle (trois hommes pour une femme). Le diagnostic est fait généralement entre trente et quarante ans et les hernies de la ligne blanche constituent entre 0,5% et 5% des hernies opérées. Cette faible proportion s'explique par la pauvreté des symptômes dont elle s'accompagne.
Il faut la distinguer du diastasis des muscles droits de l'abdomen, qui n'est pas une hernie au sens propre du terme, mais un relâchement de la ligne blanche.
Anatomo-pathologie de la ligne blanche
Nous avons étudié précédemment la constitution anatomique de la ligne blanche. Le fait qu'elle soit beaucoup plus étroite en dessous de l'ombilic qu'en dessus, où elle peut atteindre 2,5 cm de large, explique la localisation des hernies presque exclusivement supra-ombilicale. Nous avons aussi vu que la ligne blanche, chez 30% de la population, n'était pas renforcée à l'étage supérieur par la triple rangée de décussations qui contribue à sa solidité. Il va de soi que cette particularité structurale n'est qu'un facteur favorisant l'apparition d'une hernie de la ligne blanche. Mais d'autres facteurs entrent en cause. Moschowitz a évoqué au début du siècle [20] l'existence de vaisseaux perforant la ligne blanche, permettant à la graisse pré-péritonéale contenue dans le ligament rond de s'insinuer à travers les espaces créés par ces vaisseaux et de former des sortes de logettes, favorisant ainsi la survenue d'une hernie de la ligne blanche. La hernie se formerait ainsi à l'instar des diverticules coliques. Cependant cette théorie a engendré une vive controverse et a été invalidée vingt ans plus tard par Pollack [25] qui n'a que très rarement trouvé des vaisseaux sanguins accompagnant le sac herniaire. Mais il ne faut pas oublier que, comme pour l'ensemble de la pathologie herniaire, toute augmentation de la pression intra-abdominale est susceptible d'entraîner une hernie de la ligne blanche. Et l'incidence beaucoup plus élevée chez l'homme, souvent astreint à des travaux physiques plus intenses que la femme, appuie cet argument.
Comme la symptomatologie et le traitement de la hernie de la ligne blanche sont semblables à ceux de l'éventration, nous les traiterons dans le chapitre suivant.
Les éventrations [8,9,10,32]
Définition
Dans la terminologie française, on distingue les éventrations spontanées, qui s'observent fréquemment chez la femme multipare, des éventrations cicatricielles. Les premières se caractérisent anatomiquement par un diastasis anormal des muscles droits de l'abdomen entre lesquels la masse intestinale vient faire saille pendant les efforts. Ce diastasis est maximum en dessous de l'ombilic et peut atteindre 10 à 12 cm. Ces éventrations diffèrent des éventrations cicatricielles par le fait qu'on ne trouve pas de solution de continuité de l'aponévrose des muscles de la paroi abdominale et de la ligne blanche. Nous ne traiterons pas des éventrations spontanées dans notre travail, car les indications opératoires sont très restreintes et les répercussions physio-pathologiques négligeables. Nous appellerons donc éventrations celles qui sont consécutives à une laparotomie ou un traumatisme abdominal.
Genèse
Les éventrations sont uniques, dans le sens qu'elles sont les seules hernies qui peuvent être considérées comme iatrogènes, à l'exception des traumatismes de la paroi abdominale. Une incision verticale, en particulier médiane, est théoriquement beaucoup plus délétère pour la paroi abdominale qu'une incision transverse ou oblique. En effet, une laparotomie médiane sectionne toutes les couches aponévrotiques à leur point le plus critique, là où elles décussent, rompant ainsi l'harmonie des couples musculaires décrits plus hauts [4]. La cicatrice postopératoire d'une incision médiane immobilise la ligne blanche, en empêchant les formations aponévrotiques de glisser les unes sur les autres. La fonction des muscles droits est ainsi limitée, en particulier dans leur extension. Toute élévation de la pression intra-abdominale aboutira sur une ligne blanche immobilisée à une augmentation des forces de tension qui s'exercent sur elle. La ligne blanche, déjà fragilisée par la perte de son architecture, risque de se rompre et de former ainsi une éventration.
Une fois l'intégrité de la paroi rompue, la cicatrisation pariétale se fera en deuxième intention, avec la formation d'un cal fibreux circulaire. Elle est consécutive à la désunion puis à l'écartement progressif des berges aponévrotiques sous l'effet de la poussée abdominale. Les points d'ancrage aponévrotique ayant cédé, les sollicitation mécaniques qui s'exercent sur la paroi ne sont plus ordonnées. L'armature collagène du matériau fibreux qui comble l'aire centrale entre les berges aponévrotiques ne peut plus, au cours de son développement, s'orienter de façon régulière. La résistance qu'elle offre alors à la poussée des viscères abdominaux est insuffisante pour les contenir et, progressivement, l'éventration apparaît. L'organisation ovalaire, puis circulaire du cal fibreux, ainsi que l'épaississement de son pourtour, constituent une adaptation fonctionnelle destinée à compenser la faiblesse de sa partie centrale. Mais cette organisation géométrique est généralement insuffisante, et l'orifice d'éventration s'agrandit.
Suivant l'importance et la localisation de la désunion des berges aponévrotiques, il existe un ou plusieurs orifices d'éventration de taille inégale, étagés sur l'emplacement de la ligne de suture. Le pont fibreux qui subsiste entre les différents orifices est de qualité mécanique médiocre, car l'armature collagène s'y est organisée dans de mauvaises conditions de traction. Il fait partie de la zone éventrée. Dans tous les cas, la limite réelle d'une éventration n'est pas représentée par le bord de l'orifice. En effet, ce dernier, entouré par une couronne de plus ou moins grande dimension, est composée de tissu aponévrotique distendu, dont l'armature collagène est désorganisée, et de tissu musculaire atrophié. L'éventration est toujours plus large qu'il n'y paraît et la mesure du diamètre maximal se son collet ne suffit pas pour la caractériser.
Anatomie
Une éventration est constituée par trois structures morphologiquement bien distinctes :
-
Par la peau, portant sous forme d'une cicatrice large et gaufrée la trace de l'opération première.
-
Par une couche musculo-aponévrotique amincie, distendue, adhérente à la cicatrice cutanée et au péritoine. Cette couche peut manquer complètement : le sac tapisse alors directement la face profonde de la peau, comme dans les hernies ombilicales.
-
Par le péritoine, qui forme un véritable sac, parfois libre, souvent adhérent à la cicatrice fibro-cutanée, dans laquelle peuvent pousser des diverticules plus ou moins volumineux.
Parmi les éventrations cicatricielles, les unes sont consécutives à des plaies accidentelles de la paroi abdominale, mais la plupart compliquent une plaie opératoire.
-
Les petites éventrations se produisent au niveau d'une petite cicatrice (orifice de trocart par exemple) ou sur un court segment d'une longue laparotomie. Il existe alors un véritable orifice herniaire, de dimension modérée (< 5cm). Cet orifice peut livrer passage à une anse intestinale assez volumineuse qui, dans son enveloppe péritonéale, vient se loger dans la couche cellulaire sous-cutanée. Si les muscles sont peu écartés et solides, la cure opératoire classique est alors facile et généralement efficace.
-
Les grosses éventrations résultent de la rupture et de la distension progressive d'une longue cicatrice. En pareil cas, les muscles sont relâchés, les aponévroses rétractées et les berges de l'éventration sont largement écartées. On note une perte de la fonction même de la paroi abdominale sur laquelle nous reviendrons plus loin. Ce type d'éventration a toujours posé un réel problème, car la tension nécessaire au rapprochement des berges est considérable et les tissus, déjà de mauvaise qualité, se déchirent au serrage du fil.
Présentation clinique
Une éventration est une solution de continuité de l'aponévrose. Les patients ou le clinicien s'en aperçoivent en constatant une « boule » impulsive à la toux, en regard de la cicatrice de la paroi abdominale, détectée visuellement ou à la palpation directe. Toute manoeuvre augmentant la pression intra-abdominale, comme les mouvements de toux ou la position debout par exemple, rend l'éventration protubérante, pour autant que cette dernière ne soit pas fixée.
Les patients porteurs d'une petite éventration non compliquée présentent une symptomatologie assez pauvre, tout au plus une gêne minime. En revanche, les patients présentant une grosse éventration peuvent avoir de la peine à se plier, décrire une sensation d'inconfort et avoir des douleurs abdominales persistantes. Parfois, ils présentent même des troubles respiratoires, sur la physiopathologie desquels nous reviendrons plus loin, ou encore des épisodes d'iléus transitoire intermittent en relation avec un viscère coincé dans le collet de l'éventration. La perte de force compressive de la paroi abdominale lors du Valsalva peut entraîner une constipation chronique ou encore des fécalomes, notion souvent oubliée par certains praticiens qui prescrivent alors des laxatifs qui on un effet néfaste.
D'après notre collectif de patients, ce qui décide le plus souvent les gens à consulter et accepter de se faire traiter, ce n'est pas la douleur, ni même la gêne. Mais c'est cette sensation inconfortable de sentir leur paroi qui se dérobe à chaque contraction de la musculature abdominale pour faire apparaître une masse sous la cicatrice. Ils ont peur de cette « boule qui a tendance à grossir », ils ont l'impression que les « intestins vont sortir ».
Le diagnostic est le plus souvent clinique. Mais comme l'éventration peut se révéler sous forme d'une masse abdominale (comme c'est le cas pour les éventrations fixées) ou encore de douleurs abdominales intermittentes, bien des médecins la diagnostiquent grâce au scanner abdominal.
La majorité des patients attendent plusieurs années avant de se faire opérer de leur éventration. Ce n'est que lorsque celle-ci est d'une taille invalidante ou qu'elle s'accompagne de symptômes qu'ils se décident à subir une cure chirurgicale. Dans une étude parue en 1985 dans le British journal of Surgery [21], Mudge évoque le rôle important que joue le médecin traitant avec ses patients présentant une éventration. En effet, sur 18 patients qui ont consulté leur médecin traitant pour une éventration, 11 étaient symptomatiques. Seulement 6 d'entre eux (55%) ont été adressés à un chirurgien pour avis chirurgical. Cette proportion est encore nettement inférieure pour les patients asymptomatiques, le médecin traitant estimant le plus souvent que les résultats médiocres d'une cure classique (20-50% de récidive) ne valent pas les risques liés à l'acte opératoire. Cette petite parenthèse me semble indispensable pour insister sur l'importance de la communication entre le médecin traitant et le chirurgien. Nous devons l'informer que l'expectative dans ce type de pathologie typiquement chirurgicale n'est pas le bon choix. En effet, une éventration ne peut que s'agrandir avec le temps, et être d'autant plus difficile à opérer, devenir symptomatique et s'accompagner de répercussions fonctionnelles handicapantes. Mais surtout, le sac herniaire d'une éventration risque toujours de s'étrangler, ce qui devient une urgence chirurgicale grevée d'une mortalité (1,1% en cas de cure en urgence, contre 0,3% en cas de geste électif [14]) et morbidité péri-opératoire non négligeable. D'après une étude portant sur un collectif de 206 personnes âgées opérés d'une éventration [19], l'indication opératoire a été posée en urgence chez 17% d'entre elles, sur étranglement, ce qui donne à réfléchir.
Quand survient l'éventration ?
La littérature est abondante à ce sujet, et souvent contradictoire. La majorité des travaux ont été faits grâce à l'expérimentation animale, et les résultats sont très disparates. En effet, 90% de la cicatrisation est atteint après 9 jours, 70 jours ou 1 an selon les études. Cette confusion vient du fait que cicatrisation et résistance sont souvent utilisées de paire.
La cicatrisation va dépendre de la vascularisation, d'une part, et des forces de traction qui' s'exercent sur les structures aponévrotiques, d'autre part. Lorsqu'un tissu est bien vascularisé, il lui faut 9 jours pour cicatriser. Par exemple, une anastomose digestive, où les tissus sont richement vascularisés et la traction est nulle, est solide après 5 jours. Pour la paroi, le problème est identique. Cependant, les fascia sont presque avasculaires et les forces de traction exercées sont plus importantes que pour un autre tissu, d'où une rupture d'effort possible à court ou moyen terme.
La résistance du tissu de collagène va dépendre de deux facteurs : d'une part la quantité de collagène, et d'autre part l'organisation secondaire des fibres qui le composent. Si après six semaines on peut admettre que la quantité de fibres de collagène est suffisante, le tissu conjonctif n'en a pas pour autant sa structure définitive. Il faut la présence des ponts disulfures, appelés cross-linking, pour garantir la solidité du fascia. Ceux-ci peuvent mettre plus d'une année à se former. Si l'on soumet une plaie à des inhibiteurs de la lysine-oxydase, enzyme responsable de la formation des ponts disulfures, on constatera dans 95% des cas une éventration. On admet actuellement qu'après une augmentation rapide de la résistance, parallèlement à la synthèse des fibres de collagènes, la courbe s'aplatit pour prendre une forme exponentielle qui résulte de la formation très lente des ponts disulfures.
On sait qu'il s'écoule un laps de temps important jusqu'à ce que l'éventration soit cliniquement décelable. L'éventration est-elle un phénomène tardif se produisant sur une cicatrice à terme ou un phénomène précoce pouvant évoluer lentement jusqu'à ce qu'elle se manifeste cliniquement ? Dans un travail paru en 1989 [25], Pollack a eu l'idée de faire un travail prospectif chez 149 patients, en mettant des clips en métal sur la suture de l'aponévrose juste après une laparotomie majeure avec une radiographie de l'abdomen un mois plus tard. Sur 18 patients qui ont développé une éventration dans les 18 mois de follow-up, 17 montraient déjà un écartement des clips sur le cliché radiologique à quatre semaines. Un seul des 131 patients restants a présenté une éventration sans écartement significatif des clips à un mois. Aucun patient n'a montré un écartement des clips sans développer une éventration. Ce travail montre qu'il apparaît très tôt une solution de continuité au niveau du fascia, et qu'elle est un facteur prédictif évident de la survenue d'une éventration.
Parmi les nombreux travaux traitant de l'éventration et de son incidence, beaucoup ont un temps de recul trop faible, inférieur à trois ans. En effet, l'éventration peut ne se manifester que tardivement. Ainsi, Mudge a suivi sur 10 ans 337 patients ayant eu une chirurgie abdominale majeure, mais élective [18]. Sur ce collectif, 37 ont développé une éventration, à savoir 11%. Mais ce qui est surprenant, c'est de savoir que chez 35% d'entre eux, cette éventration ne s'est manifestée cliniquement qu'après 5 ans. Ces chiffres sont bien sûr élevés, mais ils nous montrent bien qu'un recul suffisant est absolument nécessaire, au minimum trois ans, si l'on veut parler de l'incidence de l'éventration ou de sa récidive. On admet actuellement que, toute chirurgie abdominale confondue, 50% des éventrations surviennent dans les cinq premiers mois, 70% dans les deux premières années et 97% au bout de cinq ans.[15].
Étiologies de l'éventration [9,32,11]
De nombreux facteurs peuvent favoriser la survenue d'une éventration ou influencer sa progression. Nous allons énumérer ci-dessous les principaux.
L'obésité
En plus des nombreuses autres complications dont l'obésité est responsable, elle représente l'une des principales causes d'éventration. Wantz, dans son atlas sur la pathologie herniaire, en débutant le chapitre des éventrations écrit : « patients with incisional hernias are invariably obese ». En effet, l'excès de graisse intra-abdominale, qui est d'ailleurs fréquente chez l'homme, exerce une pression sur la cicatrice lors de chaque contraction de la musculature abdominale dans la période post-opératoire. Sur un terrain où la masse musculaire est déjà diminuée et flasque, l'obésité devient un facteur redoutable dans la survenue d'une éventration.
Souvent le chirurgien exige une perte pondérale avant de procéder à une cure d'éventration. On peut comprendre cette attitude quand on connaît les risques per et périopératoires qui grèvent la chirurgie du patient obèse. Cependant, souvent les patients ne perdent pas un gramme ou reprennent immédiatement le poids perdu. De plus, ils ressentent cette condition comme une agression qui n'est pas sans conséquence sur leur psychisme.
Il faut donc admettre qu'obésité et éventration sont souvent liées, et que l'obésité constitue un facteur de risque qu'on ne peut traiter par de simples paroles. C'est une des nombreuses raisons qui nous font penser qu'un renforcement prothétique lors de la cure d'éventration est indispensable chez ce type de patients.
L'infection
C'est la cause la plus fréquemment évoquée dans la littérature comme responsable de l'éventration. Il est vrai qu'elle en augmente considérablement l'incidence et que le nombre de plaies post-opératoires infectées est sous-estimé. En effet, bien que l'infection de plaie ou de paroi s'accompagne souvent d'une extériorisation de pus, il existe une forme subclinique qui ne se manifeste que par une rougeur et une sensibilité de la plaie, sans écoulement purulent. Cette forme peut aussi diminuer la qualité de la cicatrisation. Un processus infectieux interfère avec la production de collagène et la formation des cross-linking. La cicatrice est alors moins résistante et propice à la survenue d'une éventration.
Dans une étude portant sur 1129 laparotomies parue en 1982 dans le british journal of medicine [7], Bucknall a remarqué que 48% des éventrations étaient consécutives à une infection. Le risque de développer une éventration est cinq fois plus important après une infection de la plaie opératoire. En effet, 23% des laparotomies avec infection de plaie se compliquent d'une éventration, contre 4,5% sans infection de plaie. D'autres études ont confirmé ces chiffres.
Pour autant que l'on admette que la contamination soit peropératoire, les complications infectieuses peuvent être diminuées par une prophylaxie antibiotique appropriée, encore que leur nécessité soit discutée et non prouvée. Il faut en outre toujours veiller aux règles d'asepsie habituelles, préparer la peau (rasage juste avant l'incision), ne pas abuser des ligatures (matériel étranger) ou de la coagulation (nécrose), ne pas mettre de drain inutile, faire une hémostase parfaite et rincer abondamment la paroi avant la fermeture.
Le type d'incision
D'après les considérations anatomiques décrites plus haut, tout porte à croire que l'incision transverse a moins de risque de se compliquer d'une éventration qu'une incision médiane qui sectionne perpendiculairement toutes les couches aponévrotiques. En effet, si l'on considère une incision sous-costale, quatre des six couches aponévrotiques sont parallèles au rebord costal et donc seules deux couches seront sectionnées. En dessous de l'ombilic, les incisions parallèles au ligament inguinal ménagent la paroi car elles vont dans le sens des fibres aponévrotiques du m. oblique externe et du m. transverse et sectionnent obliquement celles de l'oblique interne. Plus près de la symphyse, cette même incision est parallèle à toutes les fibres aponévrotiques, comme c'est le cas pour l'incision de Pfannenstiel. Beaucoup d'études tendent à confirmer cette théorie, en avançant des chiffres tels que le 83% des éventrations sont consécutives à une laparotomie médiane. Cependant, des auteurs se sont intéressés plus particulièrement au problème et ont mené plusieurs études en se basant uniquement sur des laparotomies électives [28,12]. Ils n'ont remarqué aucune différence significative dans l'incidence de l'éventration suivant le siège de l'incision. En effet, la majorité des chirurgiens préfèreront la voie médiane pour une intervention digestive lourde, pour une intervention septique qui permet de rincer tous les recoins de la cavité abdominale ou encore pour une laparotomie exploratrice en urgence. La paroi est souvent traumatisée lors de ce type d'intervention (longueur de l'intervention, complications infectieuses, ischémie due à la traction excessive des écarteurs), ce qui altère la qualité de la cicatrisation. L'éventration dépendrait alors plus du type de chirurgie, et de ses complications post-opératoires, que du type d'incision.
Suture et matériel de fermeture
La manière de fermer une paroi, de même que le matériel utilisé, sont très variables et dépendent beaucoup de l'habitude du chirurgien et de son expérience. Comme nous l'avons vu, dans les premières semaines qui suivent une laparotomie, la cicatrisation n'est pas suffisante pour assurer une bonne résistance de la paroi. Durant la première phase de la cicatrisation, le matériel de suture joue donc un rôle capital dans le maintien de l'intégrité de la fermeture. Actuellement, avec l'évolution des composantes du fil qui ne sont plus des « trappes à bactéries » , beaucoup préfèrent nettement utiliser pour fermer une paroi des fils de structure monofilamentaire très lentement résorbables comme le polyglyconate [Maxon®] plutôt que des fils tressés tels que le polyglactin [Vicryl®] ou le polyglycolate [Dexon®] qui se dégradent trop rapidement. Certains auteurs préconisent même l'utilisation de fils non-résorbables comme le polypropylène [Prolene®], dont la structure monofilamentaire, résistante aux forces de tension, n'offre pas de prise aux bactéries et est bien tolérée par les tissus.
La technique de fermeture joue aussi un rôle. Le surjet continu, comme il est généralement pratiqué pour la fermeture d'une paroi, suscite de vives controverses. Beaucoup de chirurgiens recommandent d'interrompre régulièrement le surjet par un noeud, afin de maintenir la tension du fil. Mais le surjet continu a l'avantage d'être nettement moins ischémique qu'un surjet interrompu et diminue les risques de nécrose. Les points simples de fermeture n'offrent pas d'avantage sur une fermeture en surjet. Mais, quelle que soit la technique, il est indispensable de faire passer le fil de manière extramusculaire, et donc strictement aponévrotique.
A l'Hôpital de La Gruyère, nous utilisons un fil lentement résorbable, habituellement le Dexon®, et fermons la paroi en surjet simple.
Malnutrition
Les patients dénutris, en particulier ceux dont la perte pondérale est rapide, ont plus de risque de développer une éventration ultérieure. En effet, il manque souvent la concentration d'acides aminés suffisante pour permettre la synthèse de collagène nécessaire à une bonne cicatrisation. Les taux bas de protéines sont en quelque sorte le témoin chimique de la carence nutritive. L'expérience a montré que la nutrition parentérale préopératoire n'a aucune influence sur la protéinémie ou autres indicateurs de malnutrition.
Dans notre service, nous avons l'habitude de procéder à une nutrition entérale préopératoire pendant les quelques jours qui précèdent une laparotomie majeure chez tout patient cachectique ou dénutri. Nous utilisons du Nutrodrip Energy, que nous administrons par une petite sonde naso-gastrique (freka) à raison de deux fois 500 ml par 24 heures, en général après calculation du besoin énergétique (1,2 g de protéines/kg/j, 30 kcal/kg/j). Nous continuons la nutrition entérale pendant la première semaine post-opératoire.
Complications pulmonaires post-opératoires
Lorsque le patient est sujet à de nombreux accès de toux dans la période post-opératoire, fréquents chez le patient tabagique, l'augmentation de la pression intra-abdominale tend les fils qui ont tendance à déchirer les tissus. Le risque de développer une éventration, mais aussi d'éviscérer, est alors nettement augmenté. D'ailleurs, dans de nombreux cas, l'éviscération ne se manifeste pas toujours avec l'extériorisation de sang par la plaie ou pire encore avec mise à nu des anses intestinale. En effet, l'éviscération peut être occulte, et ne se manifester que par un tiraillement au niveau de la cicatrice. Dans de tels cas, la peau peut se refermer, mais l'éventration est déjà présente.
Chez de tels patients, nous fermons la paroi par un surjet simple qui est plus souple, et par conséquent évite l'ischémie du tissu lors des augmentations de pression intra-abdominale. Nous la renforçons systématiquement avec des plaques Sandoz pendant trois semaines. Nous procédons bien évidemment à une physiothérapie respiratoire pré et post-opératoire avec au besoin l'administration d'antitussifs.
Ascite
En cas de cirrhose par exemple, l'augmentation de la pression intra-abdominale due à l'accumulation d'ascite, souvent associé à une cachexie, augmente considérablement les risques d'éventration. Par ailleurs, l'ascite accélère fortement la vitesse de résorption des fils, et l'utilisation d'un fil non résorbable est préférable dans de pareils cas.
Les stéroïdes
Par leur inhibition de la lysine-oxydase, les stéroïdes administrés de manière chronique interfèrent avec la formation de collagène, et par conséquent augmentent les risques d'éventration. En 1996, Sugermann [35] a comparé le risque de développer une éventration chez des patients souffrant d'obésité d'une part, et d'autre part chez d'autres sous traitement chronique de stéroïdes. Les premiers ont subi un by-pass gastrique, et les seconds, souffrant de RCUH, ont subi une colectomie totale avec poche ileo-anale. Dans les deux cas, la laparotomie s'est faite en xipho-pubienne. L'incidence d'éventration s'est élevé à 20% chez les patients obèses, contre 4% dans le collectif de patients atteints de RCUH. Ce travail démontre bien que l'obésité est beaucoup plus délétère pour la cicatrisation d'une paroi que l'administration continue de stéroïdes en quantité thérapeutique. Cependant, ces résultats peuvent perdre de leur intérêt car le type de chirurgie joue certainement un rôle non négligeable dans l'apparition d'une éventration, ce qui fausse les résultats de cette étude. En effet, dans notre collectif de cas, pour des patients de même corpulence avec la même incision, la chirurgie gastrique se complique plus souvent d'éventrations que la chirurgie colique. Néanmoins, opérer une éventration chez un patient sous traitement régulier de stéroïdes (10 mg/j depuis plusieurs semaines) reste une contre-indication. En revanche une médication de stéroïdes de courte durée chez un patient souffrant d'un syndrome obstructif chronique dans la période péri-opératoire ne semble pas avoir d'effet sur l'incidence d'éventrations, pour autant que la médication ne dure pas trop longtemps.
Chimiothérapie
L'effet d'une chimiothérapie péri-opératoire sur la cicatrisation d'une paroi est mal documenté. Il semblerait toutefois que les risques d'éventrations sont deux fois plus importants si une chimiothérapie suit immédiatement une laparotomie. On recommande actuellement d'attendre trois à quatre semaines avant d'entamer le traitement oncologique. Cependant, le droit de décision appartient à l'oncologue. Chez un patient oncologique souffrant d'une éventration, Il est recommandé d'attendre au moins trois mois après la dernière séance de chimiothérapie avant de procéder à une cure d'éventration.
Diabète sucré
Il est évident que les risques d'éventration sont augmentés en cas de diabète. En effet, le diabète altère considérablement tout processus de cicatrisation et augmente les risques d'infection. Cependant, il n'existe pas d'étude, à ma connaissance, qui prouve ou quantifie les risques liés au diabète dans ce type de pathologie.
Ischémie peropératoire
Depuis longtemps, on sait que la chirurgie de l'arbre aortique, comme la mise en place d'un by-pass aorto-fémoral, se complique très souvent d'une éventration. De nombreuses études ont été faites, et la plupart en viennent aux mêmes conclusions : l'ischémie peropératoire constitue un facteur favorisant l'éventration. Dans une étude portant sur 329 patients ayant subi une chirurgie infra-aortique élective, 14,9% des laparotomies se sont compliquées d'une éventration. D'après les auteurs, la perte de volume sanguin, si elle excède 1000 ml, augmente le risque d'éventration d'un facteur 3.07 contre 3.7 pour l'infection [17]. L'ischémie peropératoire due aux pertes de sang serait la seule en cause dans la survenue d'une éventration. Cependant, à notre avis, il faut aussi tenir compte que dans ce type de chirurgie, l'intervention dure longtemps et se déroule en profondeur. De plus, l'incision est longue, la microcirculation est altérée par l'athérosclérose, et les patients sont souvent tabagiques. Il s'agit là d'autres facteurs dépendant du type de chirurgie, ainsi que du type de patients, qui se cumulent les uns aux autres et font que la chirurgie aortique se complique souvent d'une éventration.
Conclusion
L'obésité et l'infection sont les deux causes principales d'éventration. On les retrouve chez plus du 90% des patients dont la laparotomie se complique d'une éventration. Les autres causes sont plutôt des facteurs favorisant l'éventration, qui, associés aux deux premières causes, en augmentent considérablement l'incidence.
Répercussions fonctionnelles de l'éventration [8]
En décrivant une anatomie fonctionnelle élémentaire de la paroi abdominale normale ou intégralement restaurée et de la paroi éventrée, nous allons préciser les bases biomécaniques sur lesquelles doit reposer le traitement des éventrations et ce qui nous motive à les traiter presque systématiquement avec un filet. Ces notions de biomécanique concernent avant tout les éventrations de grande taille et de siège médian.
Anatomie fonctionnelle de la paroi normale ou intégralement restaurée
Après la fermeture d'une paroi, la cicatrisation de première intention aboutit à la formation d'un cal fibreux linéaire sur l'emplacement de l'incision pariétale. Le fil utilisé, quelle qu'en soit la matière ou le procédé, sert de point d'ancrage provisoire qui supporte les forces de traction musculaire et assure leur répartition équilibrée. Le matériau fibreux se développe alors progressivement en orientant son armature de collagène suivant la direction ordonnée des forces auxquelles il est soumis en permanence. Avec la formation du cal fibreux linéaire, la cicatrisation pariétale en première intention assure le rétablissement des conditions normales du jeu musculaire.
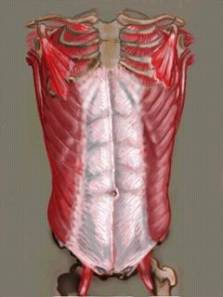
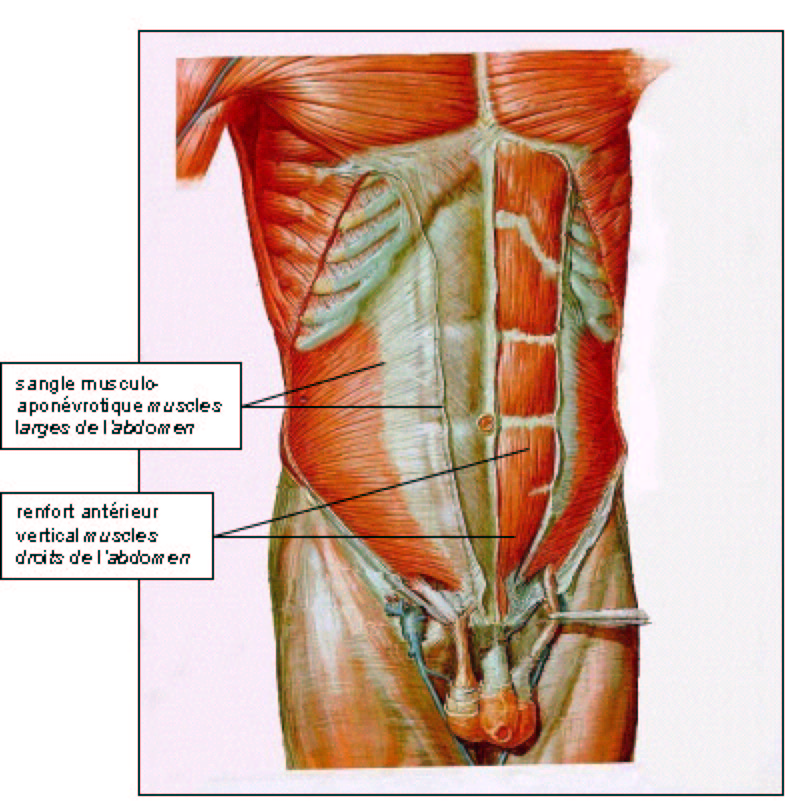
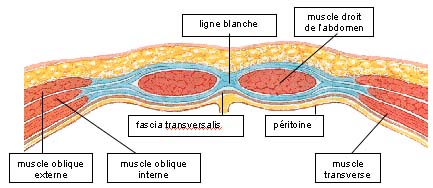
Comme décrit précédemment, la paroi est constituée de couples musculaires dont les actions se complètent (droit de l'abdomen et transverse, oblique externe et oblique interne). Mais les muscles abdominaux participent aussi aux mouvements respiratoires en associant leur action à celle du diaphragme qui est le muscle inspiratoire principal. Les muscles abdominaux et le diaphragme forment le couple musculaire principal de l'inspiration, dans lequel le diaphragme est mobilisateur et les muscles abdominaux sont stabilisateurs :
La contraction des muscles abdominaux provoque, en refoulant les viscères, une augmentation de la pression intraabdominale qui immobilise le « centre phrénique » (fig. 4). Le centre phrénique immobilisé sert alors de point d'appui aux faisceaux musculaires du diaphragme pour mobiliser les six dernières côtes et augmenter ainsi les deux diamètres, sagittal et transversal, du thorax.
Le relâchement des muscles abdominaux entraîne une diminution de la pression intraabdominale et le refoulement des viscères par le diaphragme qui ne dispose plus de point d'appui pour écarter et soulever les six dernières côtes. L'existence d'ne éventration de paroi abdominale exagère ce phénomène.
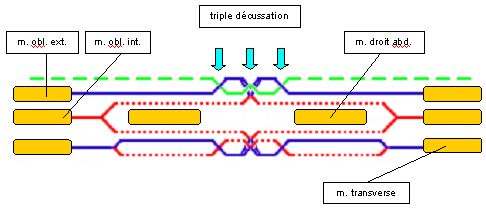
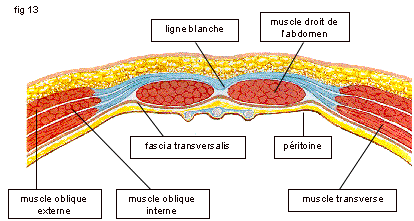
Sur les schémas qui suivent (fig. 1 et 2 [8]), la figure 1 illustre les couples musculaires formés par les muscles abdominaux et la figure 2 la rupture des couples musculaires en cas de paroi éventrée.
 Fig. 1 : Couples musculaires formés par les muscles abdominaux
Fig. 1 : Couples musculaires formés par les muscles abdominaux
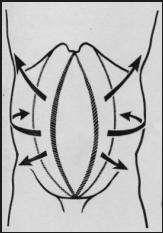 Fig. 2 : Rupture des couples musculaires en cas de paroi eventrée
Fig. 2 : Rupture des couples musculaires en cas de paroi eventrée
Couples formés par les muscles abdominaux :
-
muscle droit de l'abdomen (1) et muscle transverse (4)
-
muscle oblique externe (2) et muscle oblique interne (3)
Si les viscères se trouvent en permanence hors du ventre, dans le sac de l'éventration, un nouvel équilibre s'établit entre le jeu du diaphragme et celui des muscles abdominaux et un déséquilibre s'établit entre la pression intra-thoracique et la pression intraabdominale qui est fortement abaissée. La différence de pression de part et d'autre du diaphragme est d'autant plus importante que le sac est plus volumineux et la résistance des muscles abdominaux plus faible. J. Rives a décrit, par analogie avec les troubles dus aux volets thoraciques, « une respiration paradoxale » de l'abdomen dans ce type d'éventration. Au cours de l'inspiration, le diaphragme ne dispose plus de son point d'appui abdominal pour se contracter et mobiliser les dernières côtes, et à mesure qu'il s'abaisse, les viscères s'engagent dans le sac d'éventration. Au cours de l'expiration, le diaphragme n'est plus repoussé vers le haut, la pression intraabdominale étant insuffisante. En permanence, le diaphragme est relâché, les muscles abdominaux sont rétractés, la pression intraabdominale reste très basse. D'autres muscles respiratoires doivent être mis en jeu pour tenter de suppléer le fonctionnement perturbé du couple musculaire principal de l'inspiration, mais ils ne parviennent pas à éviter « l'épuisement respiratoire » progressif.
La diminution de la pression intraabdominale est de plus responsable du ralentissement de la circulation veineuse dans les systèmes porte et cave, ce qui augmente le risque thromboembolique, et de distension permanente des viscères creux (J.Rives). Tout comme les désordres respiratoires, ces troubles disparaîtront avec la cure chirurgicale de l'éventration qui rétablira la pression intraabdominale.
 Fig. 3 : Quand les muscles abdominaux sont relâchés, la pression intraabdominale (P) est faible en dessous du diaphragme (d.)
Fig. 3 : Quand les muscles abdominaux sont relâchés, la pression intraabdominale (P) est faible en dessous du diaphragme (d.)
 Fig. 4 : En inspiration : contraction stabilisatrice des muscles abdominaux, élévation de la pression intraabdominale (P+), et contraction du diaphragme mobilisatrice des dernières côtes
Fig. 4 : En inspiration : contraction stabilisatrice des muscles abdominaux, élévation de la pression intraabdominale (P+), et contraction du diaphragme mobilisatrice des dernières côtes
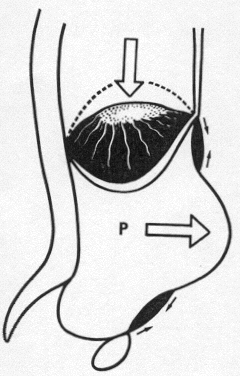 Fig. 5 : Rupture du couple musculaire de l'inspiration
Fig. 5 : Rupture du couple musculaire de l'inspiration
Traitement de l'éventration
L'objectif du traitement de l'éventration (fig. 6) ne doit être seulement de fermer un orifice pariétal mais de restaurer les fonctions de la paroi abdominale. Il faut rendre aux muscles abdominaux leur point d'appui commun antérieur et la tension naturelle de leurs fibres qui rétabliront une pression intraabdominale normale, permettant ainsi le jeu du couple inspiratoire principal.
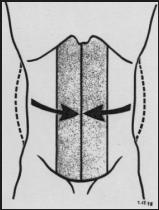 Fig. 6 : Objectif du traitement de l'éventration [13]
Fig. 6 : Objectif du traitement de l'éventration [13]
Si les troubles respiratoires sont importants, la restauration subite d'une pression intraabdominale normale peut avoir de fâcheuses conséquences respiratoire et thromboemboliques. Il y a encore quelques années, avant la modernisation du matériel anesthésique, en cas de volumineuse éventration, durant les trois semaines préopératoires, le chirurgien insufflait un pneumopéritoine progressif. Au cours de la première séance, il introduisait 500 à 1000 ml d'air dans la cavité péritonéale. Cette quantité était progressivement augmentée au cours des séances suivantes , qui s'échelonnaient sur une période d'environ trois semaines. Au total, 10 à 40 litres d'air étaient délivrés, selon la tolérance du patient. Ainsi, avant l'intervention, le patient avait retrouvé un jeu diaphragmatique normal et une meilleure circulation veineuse. De plus, l'intervention était plus confortable pour le chirurgien car le pneumopéritoine faisait céder la rétraction des muscles abdominaux jusqu'à provoquer leur élongation temporaire, ce qui facilitait la réintégration des anses et leur maintien dans la cavité abdominale. De nos jours, grâce aux appareils à respiration assistée en pression positive, nous préférons garder au besoin le patient intubé pendant quelques jours. L'extubation se passe généralement sans difficulté. Cependant, une ventilation assistée dans les jours qui suivent une cure d'éventration augmente la pression intraabdominale, et par conséquent les risques de récidive lors d'une cure classique. Nous reviendrons sur ce problème plus loin, en parlant des indications à poser un filet.
Dans les cures classiques, de nombreuses techniques ont été décrites. Elles visent à refermer la paroi après excision des berges de l'éventration, avec une fermeture en gilet, en utilisant un fil lentement résorbable ou non résorbable. Nous ne décrirons pas les différentes techniques, ces dernières nous semblant réservées uniquement aux petites éventrations, chez des patients non obèses et à paroi saine.
De nos jours, un nombre croissant de chirurgiens utilisent un matériel composite, appelé communément « filet », pour corriger l'éventration. Posé de manière correcte, il constitue un progrès considérable dans la chirurgie pariétale qu'il est en train de révolutionner. En effet, il diminue considérablement le risque de récidive est et est bien toléré par le patient. Il est à la base de notre travail, raison pour laquelle nous allons le traiter de manière plus approfondie dans le chapitre qui va suivre.
Le filet
Histoire
La pathologie herniaire est connue depuis la nuit des temps. A ma connaissance, les premiers à avoir essayé de traiter les hernies inguinales en se servant d'un matériau pouvant s'apparenter au « filet » sont les égyptiens. Ils inséraient une feuille de papyrus au niveau de l'orifice herniaire ; le papyrus s'infectait, provoquant une intense réaction inflammatoire qui finissait par une fibrose de la paroi pour autant que le patient n'ait pas succombé de complications infectieuses. le but recherché par l'introduction d'un corps étranger était atteint.
Mais tout commence à la fin du 19ème siècle. Devant le nombre d'échecs de la cure de hernie par fermeture simple, des chirurgiens tentèrent d'utiliser un matériau étranger pour réparer la paroi abdominale. Cherchant à renforcer la paroi avec une matière capable de résister aux contraintes mécaniques, ils essayèrent d'insérer des treillis métalliques. En 1889, l'allemand Witzel a utilisé un treillis en argent, suivi 11 ans plus tard par Goepel. En 1901, Busse a expérimenté des plaques d'or, et d'autres de l'aluminium, du cuivre, ou encore des alliages. Tous ces essais avec des treillis métalliques se sont soldés par des échecs, ce qui a conduit à leur abandon pour quelques années. Nous remontons alors jusqu'en 1940, avec l'arrivée du tantalum et de l'acier inoxydable. Des essais tout aussi peu concluants que les premiers ont abouti à leur abandon dans les années 50. En effet, la rigidité des treillis métalliques est très inconfortable pour le patient ; ils se durcissent avec le temps, sont friables et se fragmentent petit à petit. De plus, ils sont dotés d'une grande inertie biologique, ce qui leur permet de migrer à travers les tissus et ainsi de léser dangereusement les organes creux. De nombreux cas de lésions artérielles, perforations intestinales et fistules ont été décrits dans la littérature.
Après la deuxième guerre mondiale, l'industrie chimique s'est rapidement développée. Les chercheurs ont crée de nouveaux matériaux, qu'ils appelaient injustement « plastiques ». En fait, c'est le début des prothèses synthétiques qui vont révolutionner un bon nombre d'interventions chirurgicales. Les formes utilisées en chirurgie sont les alcools de polyvinyl (Ivalon Sponge®), le polyéthylène, le polypropylène (Prolene®, Marlex®), les polymères de fluor (polytetrafluoroéthylène : PTFE®), les polyamides (nylon) et les polyesters saturés à haute densité moléculaire (Mersilène®). Contrairement aux treillis métalliques, ces matériaux plus souples provoquent une intense réaction inflammatoire entraînant une colonisation des mailles par un tissu de collagène solide qui assure la solidité de la paroi.
Ces nouveaux matériaux, particulièrement dans les pays anglo-saxons, n'ont pas eu l'essor que l'on aurait pu attendre. En effet, implanter un « corps étranger » dont on ne connaissait pas encore les effets à long terme a découragé beaucoup de chirurgiens qui n'ont pas voulu courir le risque de les utiliser pour traiter une maladie somme toute bénigne. D'autres, en revanche, pour ne citer que Bourret, et bien sûr Stoppa, en regard du nombre d'échec des cures de hernies difficiles selon la méthode traditionnelle, ont commencé à les opérer systématiquement avec des filets. Les résultats furent surprenants. La récidive était rarissime et les complications négligeables par rapport au bénéfice d'une cure solide. Ces pionniers ont jugé la pathologie herniaire comme une maladie en tant que telle, due à une faiblesse constitutionnelle, qu'il fallait traiter par un renforcement pariétal prothétique.
Aujourd'hui, le filet non-résorbable est l'option moderne et fondamentale pour la réparation de hernies difficiles.
Avant de décrire plus en détail le filet et son comportement biologique dans la paroi, il faut rappeler qu'il est non-résorbable et que ses caractéristiques doivent répondre aux critères de Cumberland et Scales pour l'implantation d'un corps étranger.
Un corps étranger :
-
ne doit pas être altéré dans sa constitution physique par les liquides.
-
doit être chimiquement inerte.
-
ne doit pas entraîner une réaction de rejet.
-
ne doit par être carcinogène.
-
ne doit par entraîner une réaction d'hypersensibilité ou d'allergie.
-
doit être capable de résister aux contraintes mécaniques.
-
doit être facile à fabriquer, et ce dans des moindres coûts.
-
doit pouvoir être stérilisé.
Concernant le point no 4, il a été étudié en détail par Oppenheimer et coll [24] dans les années 50. Après l'introduction d'un plaque de dacron dans le tissu sous-cutané de 41 rats Wistar, il avait constaté l'apparition de sarcome après 1-2 ans dans une proportion de 20 %. En utilisant une plaque perforée de Dacron, la survenue de tumeur n'est apparue que dans une proportion de 4,8% pour une population de 42 rats. Avec une épaisseur de la plaque de dacron réduite à 0,05 mm, aucune tumeur n'a été observée dans une série de 38 rats. Chez l'homme, nous n'avons jamais observé l'apparition de cancer après la mise en place d'un filet de Mersilène®.
Biologie
J.-P. Arnaud a fait un travail expérimental à la fin des années 70 [2], en comparant chez le rat le comportement biologique de six prothèses inertes. Pour bien expliquer le rôle que doit jouer un filet dans l'organisme, je vais décrire en détail leur expérience.
L'étude porte sur 490 rats, et compare les réactions tissulaires locales macroscopiques, bactériologiques et histologiques en fonction de la nature et de la durée d'implantation du matériel placé en position intra-péritonéale. Un des buts principaux était de comparer la biologie des prothèses perméables, (à mailles), et des prothèses imperméables (plaques).
Les prothèses à maille (« mesh ») étudiées sont :
-
le treillis de nylon (Crinoplaque®),
-
l'étoffe de dacron, commercialisé sous le nom de Mersilène®. C'est un tricot très fin (0,2 mm d'épaisseur), perméable, léger (40g/m2), tissé selon le procédé « interlock » (démaillage impossible), et constitué d'espaces losangiques.
-
le treillis en acier inoxydable (Toilinox®)
Les prothèses imperméables (cloth material) sont :
-
des prothèses de silicone (Silastic®),
-
une prothèse de silicone renforcée de dacron (Silastic-Dacron®)
-
une prothèse en velours siliconé (Rhodergon®).
Macroscopiquement, la péritonisation était complète au 7ème j. post-opératoire pour toutes les prothèses perméables, à l'exception du treillis en acier où elle restait incomplète au 3ème mois. Pour les prothèses imperméables, la péritonisation n'était complète qu'au 15ème jour post-opératoire.
Les adhérences épiploïques étaient constantes, quel que soit le matériel utilisé.
Pour toutes les prothèses perméables, les mailles sont progressivement colonisées par un tissu conjonctif, d'abord lâche et oedémateux, puis fibreux. On appelle ce phénomène « incorporation » de la prothèse. En revanche, les prothèses imperméables, donc sans mailles, ne sont jamais incorporées. Bien au contraire, elles s'entourent d'une coque fibreuse plus ou moins importante suivant le matériau utilisé qui l'isole des tissus adjacents. Il se forme alors une néo-cavité à contenu séro-hématique. Ce phénomène d' « encapsulation » n'existe pas avec les prothèses perméables, mais est constant avec les prothèses imperméables. De plus ces dernières ont la capacité de migrer soit dans la cavité péritonéale, soit dans la néo-capsule ou peuvent encore être rejetées vers le plan cutané superficiel. C'est ce qu'on appelle l' « extrusion » de la prothèse, qui est une caractéristique exclusive des prothèses imperméables.
Aucune collection séro-hématique, aucun abcès, ne se sont développés au contact des prothèses perméables. A l'opposé, après implantation d'une prothèse imperméable, une collection liquidienne se développe constamment entre la prothèse et le revêtement cutané. La recherche de germes pratiquée tant au niveau de ces collections pariétales qu'au niveau du liquide contenu dans la capsule entourant le matériel prothétique, s'est révélée positive chez 11% des prothèses en silicone, 14% des prothèses en Silicone Dacron et 28% des prothèses en velours siliconé. Ces collections évoluent fréquemment vers la formation d'abcès pariétaux (malgré des ponctions évacuatrices systématiques).
La résistance mécanique de la réfection pariétale était identique après le 30èmejour postopératoire, quel que soit le matériel utilisé. Cependant, durant la période postopératoire précoce, les prothèses à mailles (perméables) sont significativement plus résistantes que les prothèses imperméables, en raison de la forte prolifération fibroblastique des prothèses perméables.
Sur la figure qui suit (fig. 6), on voit un filet de Mersilène® après plusieurs années d'implantation en position prépéritonéale. Il s'agit d'un prélèvement de paroi, fixé au formol chez un de nos patients, opéré 3 ans après la pose (fig.6, 7,et 8).
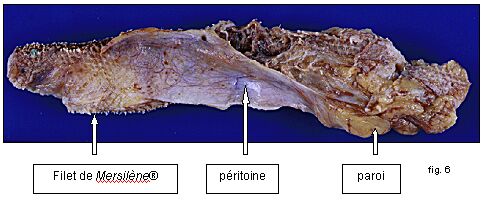 Fig. 6 : Filet de Mersilène®
Fig. 6 : Filet de Mersilène®
Histologie
L'incorporation du Tulle de dacron a été particulièrement étudiée par les auteurs. Il apparaît sur les lames histologiques formé de fascicules distants les uns des autres, regroupant une dizaine de fibres régulières, granuleuses, biréfringentes, polarisant la lumière (fig. 7) (cythopathlab, Genève).
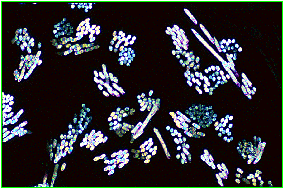 Fig. 7 : Incorporation du Tulle de dacron
Fig. 7 : Incorporation du Tulle de dacron
Quel que soit le siège d'insertion en profondeur de la prothèse, les résultats de l'examen microscopique sont superposables.
-
L'introduction de dacron provoque une réaction inflammatoire aiguë exsudative, dont l'épaisseur croît régulièrement durant la première semaine (3 mm à 9 mm). Le tissu est lâche, oedémateux, riche en fibrine et polynucléaires.
-
Puis au 5-7ème jour, le milieu s'enrichit d'éléments histiocytaires macrophagiques, puis gigantocellulaires. Les cellules géantes sont disposées à la périphérie des fibres de Mersilène®. Par conséquent, cette prolifération aboutit à la constitution d'agrégats cellulaires denses, maximum à la fin du premier mois.
-
Le dernier stade est représenté par l'apparition de bourgeons charnus et la survenue d'une activité fibroblastique. Cette prolifération conjonctivo-vasculaire, développée initialement en périphérie de la réaction cellulaire, pénètre progressivement le tissu oedémateux et tend à occuper les espaces libres situés entre les différentes sections des fibres de la trame de dacron. Cette fibrose s'intensifie au 15ème jour, les mailles de la prothèse sont complètement colonisées vers le 40ème jour. Ainsi se trouve réalisé un montage tissulaire solide qui maintient la prothèse au sein des tissus environnants.
Ci-dessous (fig. 8, cythopathlab), on voit les éléments cellulaires incorporant un filet de Mersilène® après plusieurs années
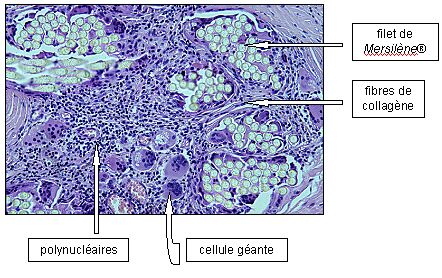 Fig. 8 : Éléments cellulaires incorporant un filet de Mersilène® après plusieurs années
Fig. 8 : Éléments cellulaires incorporant un filet de Mersilène® après plusieurs années
La cicatrisation idéale est un tissu riche en fibroblastes et en fibres de collagène. Dans le cas de prothèses à mailles, des ponts scléreux se forment et relient les différentes mailles entre elles.
Les prothèses à maille, puis les prothèses imperméables, peuvent être classées par ordre décroissant, démontrant la supériorité des prothèses perméables et tout particulièrement du treillis en dacron dans cette expérience. Les prothèses imperméables peuvent par conséquent être abandonnées, ce qui est le cas de nos jours.
On note encore un autre fait expérimental important : dans ce travail, lorsque la prothèse de Dacron est placée simplement dans la cavité péritonéale sans être fixée au plan musculo-aponévrotique, l'adhérence complète au péritoine pariétal n'a jamais été observée. Ce fait expérimental est en contradiction avec les résultats de Stoppa qui note dans plus de 90% des cas une auto-fixation de la prothèse dès le 5ème jour post-opératoire.
Le matériau et la structure de la maille (porosité) sont donc les facteurs les plus déterminants de la qualité d'un filet. Ce sont ceux qui permettent son incorporation optimale dans la paroi par stimulation fibroblastique.
Différents filets : monofilaments et multifilaments
Il existe de nombreux filets, de matière et de porosité diverse, dont le but est de permettre une intégration optimale de tissu conjonctif et d'être résistants à l'infection. Les trois filets les plus répandus sont en polypropylène, en polyester, et en ePTFE (expanded polytetrafluoroethylène), ce dernier étant peu utilisé en Europe.
Filet en polypropylène
Les filets en polypropylène sont non-résorbables. Sur le marché, on en trouve principalement trois sortes : Le Marlex® (Bard Vascular, Billerica, MA)(fig.9), le Prolene® (Ethicon, Somerville, NJ)(fig. 10), et le Surgipro® (United States Surgical, Norwalk, CT).
le Marlex® est tissé à partir d'un seul brin de polypropylène, le Prolene® à partir de deux brins et le Surgipro® à partir de plusieurs brins. Plus les brins sont nombreux, plus le filet est souple et flexible.
Le Marlex® a été le premier filet en polypropylène à arriver sur le marché, et utilisé pour la cure de hernies difficiles. Les filets en polypropylène sont actuellement les prothèses de loin les plus utilisées dans différentes interventions pariétales ou intra-abdominales.
 Fig. 9 : Filet de Marlex®
Fig. 9 : Filet de Marlex®
 Fig. 10 : Filet de Prolene®
Fig. 10 : Filet de Prolene®
Filet en polyester
On trouve les filets en fibres de polyester sous deux formes : d'une part le Dacron® (Bard Imolants Division, Billerica, MA), et le Mersilène® (Ethicon)(fig. 11). Les deux filets sont souples et flexibles, tissés à partir de fibres de polyester tressées. Le dacron est fait à partir de monofilaments de polyéthylène terephthalate ; le Mersilène® à partir de fibres en polyfilaments du même polymère.
 Fig. 11 : Filet de Mersilène®
Fig. 11 : Filet de Mersilène®
Les filets en polyester ont été développés en même temps que les filets en polypropylène. Mais ils ont été nettement moins populaires dans le monde de la chirurgie, à l'exception de la France où il est largement utilisé et a été documenté par Stoppa.
Filet en ePTFE
Le ePTFE (Gore-TEX® ; W.L. Gore et Assoc., Flagstaff, AZ) est un filet microporeux, flexible, introduit dans les années 70, et utilisé avec succès comme greffon vasculaire. En chirurgie pariétale, les premiers résultats furent décevants. Aujourd'hui, il reprend de la popularité, et est de plus en plus utilisé.
 Fig. 12 : Filet en ePTFE
Fig. 12 : Filet en ePTFE
Dans ce qui suit, nous allons comparer la porosité, les caractéristiques physiques, la solidité, l'intégration par du tissu conjonctif et la résistance à l'infection des trois types de filet suscités.
Porosité, réponse inflammatoire et colonisation de tissu conjonctif
Un filet doit être doté d'une géométrie des mailles qui lui confère une perméabilité telle que les fibrocytes qui colonisent la prothèse synthétisent les fibres de collagène, sans toutefois que l'incidence de sérome (4-6%) et d'infection (0,2-2%) ne soit élevée.
Le Marlex® et Prolene®, le Mersilène®, et le ePTFE® diffèrent les uns des autres par leur porosité :
-
Le Marlex® est composé d'un mono-filament en polypropylène de 150 µm, et ne possède aucun micropore entre les fibres. Les mailles du Marlex® mesurent 68 x 32 µm, et sont distribuées de manière régulière (fig.10). Dans sa porosité, il est comparable au Prolene® (fig.11), dont la taille des mailles est de 163 x 96 µm.
-
Le Mersilène® est composé de plusieurs filaments tressés avec des mailles de 120 x 85 µm. Il existe entre les filaments des micropores de différentes grandeurs, de moins de 50 µm.
-
Le ePTFE est composé de filaments de 140 µm de diamètre. La taille des mailles est très petite, de 10 x 20 µm, ce qui en fait un filet exclusivement microporeux.
Le Marlex®, le Prolene® et le Mersilène® sont les filets les mieux incorporés par le tissu conjonctif. Le ePTFE quant à lui, avec ses pores d'environ 20 µm ne permet pas une genèse suffisante de tissu conjonctif. En effet, les pores doivent être compris entre 75 et 100 µm pour permettre une colonisation complète de tissu conjonctif après un mois. Des mailles plus petites que 75 µm retiennent principalement les histiocytes, aux dépends des fibrocytes. L'incorporation du filet est alors moins bonne et la cure moins solide. Le ePTFE® ne s'accompagne pas d'une incorporation conjonctive suffisante pour renforcer une paroi, ce qui a considérablement ralenti son essor. Cependant, en raison de sa souplesse, des faibles adhérences qu'il provoque, il bénéficie aujourd'hui d'un regain de popularité dans les pays anglo-saxons, d'autant plus que certains travaux cliniques, sans toutefois bénéficier d'un recul suffisant, ont eu d'excellents résultats avec ce matériau posé au contact des anses intestinales.
En 1988, Pourdeyhimi [26] a mis en doute la relation entre la taille des mailles et l'incorporation de tissu conjonctif. Il a utilisé un système d'imagerie complexe lui permettant d'analyser en détail la géométrie des pores. Il a démontré qu'en réalité la taille des pores du ePTFE est sous-estimée. Selon sa technique de mesure, les pores du ePTFE, que l'on pense 10 fois plus petits que ceux du Prolene®, empêchant donc les fibres de coloniser les mailles, sont en fait tout aussi larges. La taille apparente des pores et la genèse supposée de tissu conjonctif à travers les mailles du filet ne permettraient donc pas d'affirmer la supériorité d'un filet par rapport à un autre. Dans ces conditions, le type de matériau jouerait un rôle certainement tout aussi important.
Mais dans l'utilisation d'un filet, on doit également prendre en compte certaines caractéristiques physiques, tels que souplesse et épaisseur, que l'on va traiter dans le chapitre suivant.
Caractéristiques physiques
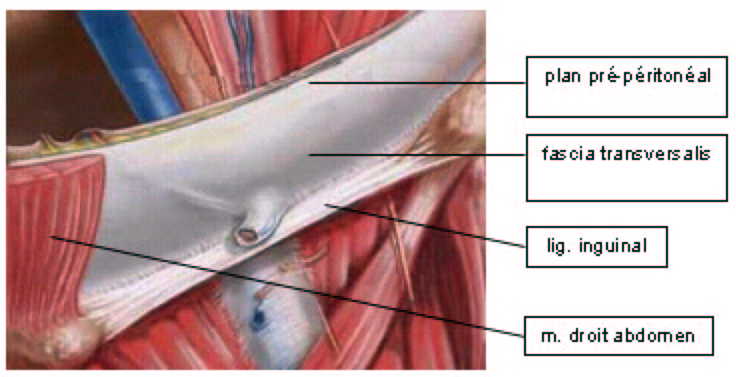
La porosité d'un filet n'est pas sans influence sur sa consistance. En effet, un filet macroporeux est semi-rigide alors qu'un un filet microporeux est souple. Le Prolene®, qui est macroporeux, a pour avantage sa fermeté. Un tel filet est d'un maniement facile. En revanche, il s'insinue difficilement, voire pas du tout dans les recoins d'une surface qui n'est pas lisse, comme une paroi abdominale. Le Mersilène®, en filaments tressés, partiellement microporeux, est beaucoup plus souple. Il s'adapte harmonieusement à toutes les formes d'anatomie et adhère fermement aux tissus, ce qui lui confère une grande stabilité. D'après Stoppa, la fixation aux structures musculo-aponévrotiques de grandes prothèses de Mersilène® serait de ce fait même inutile. En effet, la sécurité dans la fixation d'une prothèse réside principalement dans sa stabilité. Stoppa pose des filets de Mersilène dans le plan pré-péritonéal, ce qui empêche la prothèse de migrer et rend son incorporation très rapide. En l'absence de fixation, la paroi règlerait automatiquement la tension que doit exercer la prothèse, conférant ainsi une cure parfaitement physiologique. Cependant, la très grande majorité des chirurgiens fixent leur filet à une structure musculo-aponévrotique ou en bourdonnet à travers la musculature de la paroi.
Un filet doit recouvrir largement le défect de paroi dans toutes les directions et ainsi diminuer et mieux répartir les forces de tension qui agissent sur lui. Il faut savoir que la souplesse du filet de Mersilène® permet l'utilisation de prothèses de grande dimension, recouvrant très largement le défect pariétal, ce qui est un principe technique capital pour une cure de qualité. De maniement plus difficile, le filet de Mersilène® exige un apprentissage plus long pour parvenir à une technique fiable, d'où la réticence de certains opérateurs à son utilisation.
Solidité
La résistance des différentes prothèses n'est finalement pas très importante. En effet, on sait que les trois types de filets résistent à une traction bien supérieure à celle qui leur est demandée dans la réparation d'une paroi [3]. Les structures qui entourent le filet sont beaucoup moins solides que le filet qui se niche dans le tissu cicatriciel. Les zones de faiblesse sont celles qui bordent l'éventration, celles sur lesquelles les points de suture se déchirent dans une cure traditionnelle.
De nombreuses études ont été faites en remplaçant la prothèse non résorbable par un filet résorbable, notamment en polyglactin 910 (Vicryl®). Elles montrent que le tissu conjonctif qui a remplacé le filet par des fibres de collagène orientées le long des lignes de force ne résiste souvent pas à la pression intra-abdominale et qu'une récidive est beaucoup plus fréquente qu'avec un filet non-résorbable. En cas de faiblesse de paroi, un renforcement par une armature permanente reste indispensable.
Résistance à l'infection
C'est l'un des arguments le plus souvent avancé par les adeptes du filet à structure monofilamentaire pour préconiser son utilisation plutôt que toute autre prothèse. En effet, un matériau contenant des espaces plus petits que 75µm (Mersilène®) augmente théoriquement les risques d'infection. Les bactéries, mesurant en général 1µm, se nichent dans les petits pores et peuvent proliférer librement car elles sont protégées des polymorphonucléaires neutrophiles qui ont une taille comprise entre 100 et 150 µm. Le Prolene®, avec des pores réguliers de plus de 100 µm, ne favorise pas la survenue d'une infection. De plus, si par malheur ce filet s'infecte (incidence de moins de 0,3% d'après les auteurs les plus optimistes), un simple drainage et rinçage suffit. Certains auteurs opposent cette caractéristique à celle des filets partiellement microporeux (Mersilène®) dont l'infection mène obligatoirement à leur ablation immédiate.
Personnellement, je n'ai pas trouvé d'étude clinique confirmant les prédictions théoriques et montrant la supériorité des filets en monofilament en ce qui concerne leur résistance à l'infection. Une asepsie scrupuleuse lors de l'intervention, l'utilisation de drains sous vide au contact du filet en fin d'intervention et un rinçage abondant de l'abdomen avec une solution antiseptique semblent jouer un rôle beaucoup plus important que la structure du filet dans la prévention d'une infection. En cas d'infection, l'ablation s'impose, comme pour tout corps étranger implanté.
Filet et complications
Infection du filet
La complication la plus crainte de la réparation pariétale par mise en place d'un filet est l'infection. Cette dernière mène le plus souvent à l'ablation du filet en urgence avec des suites opératoires pénibles. Le patient doit rester hospitalisé pendant plusieurs jours avec une antibiothérapie parentérale, et la paroi doit être drainée jusqu'à fermeture de la plaie. On assiste quelque fois à une correction spontanée de l'éventration grâce à la fibrose réactionnelle et au remaniement des tissus dus à l'infection. Mais il s'agit là d'un échec dont beaucoup de chirurgiens ont peur et qui a considérablement retardé l'utilisation du filet. Nous verrons plus loin dans la description de la technique opératoire les différents moyens dont nous disposons et que nous préconisons pour minimiser les risques d'infection.
Formation de séromes
La formation de séromes est aussi une complication fréquente des filets. Ils sont plus fréquents lorsque la prothèse est mise en position prépéritonéale, et que le filet est microporeux. Schumpelick [33] a étudié entre autres l'incidence de séromes lors des cures d'éventration en séparant son collectif de patients en deux groupes : dans le premier, ils ont posé un filet de Prolene® en position prépéritonéale (n=82), et pour le second ils ont procédé à une cure classique (n=190). Dans les suites post-opératoires, ils ont procédé à une échographie systématique de la paroi. Ils ont trouvé une incidence de séromes de 31,1% dans le collectif avec filet, contre 13,7% dans le collectif sans filet. Ils n'ont pas toutefois précisé combien étaient cliniquement décelables. On sait actuellement qu'avec un drainage sous apiration dans le plan où est posé le filet, l'incidence de séromes cliniquement gênant est très faible et ne peut en rien être une contre-indication à la mise en place de filets en position pré-péritonéale.
Formation d'adhérences
Un filet, comme on l'a vu, provoque une intense réaction inflammatoire, s'accompagnant d'une fibrose réactionnelle, qui en assure la solidité, au prix souvent d' adhérences avec les tissus avoisinants. L'expérimentation animale, faite en premier avec les filets de Prolene®, l'a clairement démontré. De manière empirique, on peut dire que la formation d'adhérences est inversement proportionnelle aux qualités intrinsèques du filet à provoquer une réaction fibreuse. Si l'on compare chez le cochon la quantité d'adhérences consécutives à l'implantation d'un filet de Marlex®, de Prolene® ou de Gore-Tex® posé en position intrapéritonéale, les adhérences sont significativement plus importantes avec le Marlex®. Des filets actuellement utilisés, le ePTFE® provoque beaucoup moins d'adhérences que tout autre prothèse. C'est pourquoi beaucoup d'auteurs tentent de valider son utilisation en position intrapéritonéale. Mais on sait que la réponse inflammatoire induite par le ePTFE® n'est pas suffisante pour permettre une bonne incorporation par le tissu de collagène. Ce principe est contre-balancé par des études cliniques qui montrent un taux de récidive comparable aux autres filets, mais dont le recul n'est pas suffisant. Notamment celle de Gillion [13], parue en 1997 dans l'American Journal of Surgery. Son travail porte sur 158 patients opérés d'une éventration par renforcement d'un filet en ePTFE, et divisés en 2 groupes : dans l'un, la prothèse était placée en position intrapéritonéale (n=60), dans l'autre extrapéritonéale, sur l'aponévrose postérieure des muscles droits de l'abdomen, en arrière de la musculature. La tolérance à la prothèse était semblable dans les deux groupes. Le taux d'infection à court et long terme était de 3%, discrètement inférieur à la moyenne de la littérature, et un taux de récidive à 3 ans de 4%, semblable à celui des autres renforcements prothétiques. Il faut rajouter que toutes les infections à court terme (n=3) se soldant par un sepsis intraabdominal se sont produites sur les filets intrapéritonéaux.
La formation d'adhérences a été étudiée chez la souris en fonction du temps pour le filet de polypropylène® et le ePTFE®. Jusqu'à 8 semaines, les adhérences étaient beaucoup plus nombreuses avec le filet en polypropylène. Au bout de 22 semaines, le nombre d'adhérences était semblable pour les deux filets.
Pour éviter les complications liées à la maladie adhérentielle, en 1993, Soler, en collaboration avec Stoppa [34], a étudié le comportement face aux anses intestinales d'une prothèse composée mise en position intrapéritonéale. Cette prothèse était faite de la juxtaposition d'un treillis de dacron et d'un treillis de polyglactin 910 (Vicryl®), ce dernier étant bien sûr du côté intrapéritonéal. L'expérience portait sur quarante rats et les auteurs ont pris comme contrôle un filet de dacron posé dans le même plan. Les résultats furent décevants. A 6 mois, ils ont constaté une très faible activité fibroblastique au contact de la prothèse composée, et le treillis de polyglactin n'a pas été remplacé par un néo-tissu. Le treillis de polyester résiduel a contracté avec les viscères abdominaux autant d'adhérences que le treillis de polyester utilisé seul. De plus, la prothèse composée présente une tolérance biologique médiocre (réaction inflammatoire intense) et un risque d'infection accru.
A la suite de la présentation de cette étude au « meeting on hernia surgery » à St-Moritz en 1994, pour répondre aux chirurgiens préconisant la position intrapéritonéale, Stoppa répondra :
« Toute tentative de simplification et de réduction de la durée des opérations mérite d'être considérée avec attention. Le placement intra-péritonéal de matériel prothétique est plus rapide et plus simple que sa mise en place pré-péritonéale, mais reste grevé des risques induits par la maladie adhérentielle et la migration du matériel étranger à l'intérieur des organes creux ».
Migration du filet et lésions d'organes creux
D'autres complications ont été décrites, souvent en rapport avec le lieu d'implantation et la formation d'adhérences. Ceci est surtout valable pour les filets rigides en polypropylène, tels que le Marlex® ou le Prolene®. Des études à long terme ont montré que les adhérences du tulle prothétique à l'intestin peuvent entraîner une occlusion intestinale, la migration du matériel dans la lumière intestinale ou encore la formation de fistules intestinales. Il est évident qu'en position intra-péritonéale, la migration est beaucoup plus fréquente. On peut l'éviter grâce à divers moyens de fixation aux structures musculo-aponévrotiques. Certains chirurgiens fixent leur prothèse avec des fils résorbables, d'autres non-résorbables, ou encore avec des agrafes. En position pré-péritonéale, la migration est moins fréquente et ne risque pas de léser des organes creux.
Sur les 2 photographies qui suivent, on représente le cas d'un patient victime d'une fistulisation d'un filet à travers une anse grêle et le colon. Il avait été opéré en 1995 dans un hôpital de suisse romande d'une volumineuse éventration suite à une lapaostomie pour nécrosectomie d'une pancréatite aigue. Il avait développé quelques mois plus tard un écoulement intermittent par un pertruis cutané. Un fistulographie sous CT (photo 1) montre clairement la progression du produit de contraste injecté par l'orifice fistulaire à travers le jejunum, et l'angle colique gauche. Sur la pièce de résection (photo 2), on constate le filet qui a pénétré à l'intérieur de la lumière grêle et colique.
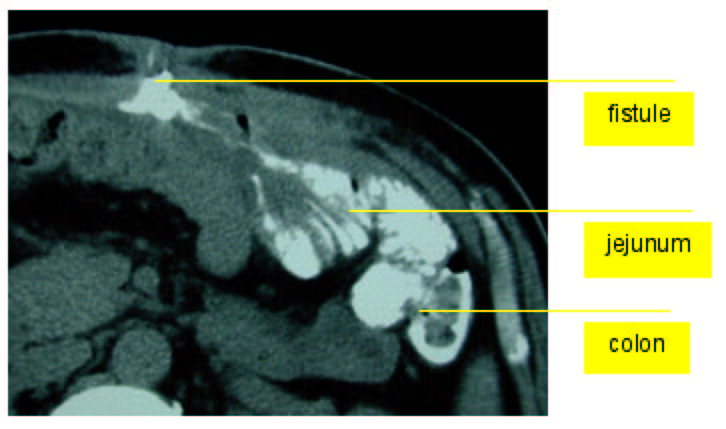 Photo 1 : Fistulographie sous CT
Photo 1 : Fistulographie sous CT
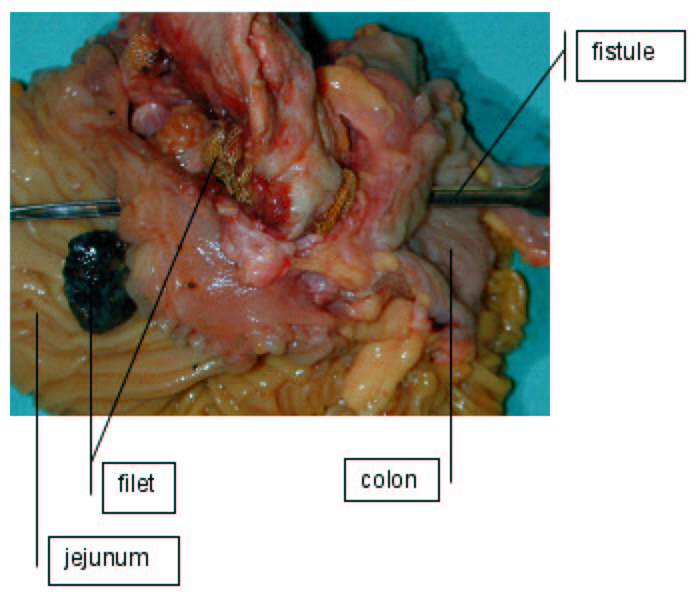 Photo 2 : Pièce de résection
Photo 2 : Pièce de résection
Le travail
But
Pour juger de la valeur d'une cure d'éventration par mise en place d'un filet de Mersilène® en position prépéritonéale, nous avons décidé d'examiner tous les patients ayant subi cette intervention à l'Hôpital de La Gruyère depuis 1987 jusqu'en 1996.
Méthode
Dans un premier temps, nous avons sélectionné tous les patients ayant été opérés d'une cure d'éventration ou cure de récidive de hernie ombilicale / hernie de la ligne blanche par mise en place d'un filet de grande taille (Mersilène®, 30x30 cm) en position prépéritonéale. Nous avons exclu les patients traités dans le même temps opératoire d'une cure de hernie inguinale et hernie ombilicale selon Stoppa. En tout, nous avons récolté 55 rapports opératoires pour 52 patients.
Puis nous avons recherché le dossier de tous ces patients et retrouvé leurs adresses. Six pourcents d'entre eux (n=3) ont quitté la région sans laisser d'adresse à leur médecin traitant et 6% (n=3) sont décédés.
Nous avons alors contacté 46 patients par écrit en leur expliquant le but de notre travail et les raisons qui nous motivent à les revoir. Seulement 3 d'entre eux ont refusé de venir à l'Hôpital de La Gruyère pour contrôle.
Chez 2 d'entre eux, le refus était motivé par des troubles de la personnalité associés à un alcoolisme sévère et chez une patiente par la peur de la consultation. Pour 2 des patients qui ont refusé de se soumettre à un examen clinique (le troisième ayant été revu fortuitement à l'hôpital) et les 3 patients décédés, nous avons contacté leurs médecins traitants qui nous ont fait part de leur dernier status de la paroi abdominale. Nous connaissons bien les médecins traitants concernés avec lesquels nous collaborons régulièrement et sommes persuadés de la fiabilité de leur examen clinique. Nous avons donc gardé ces 5 patients dans notre collectif, et le recul a été calculé en fonction du dernier examen clinique de la paroi abdominale. En revanche, nous ne disposons pas de données fiables pour les trois patients perdus, raison pour laquelle nous les avons exclus de notre collectif pour l'analyse prospective de nos données.
Au total, 35 patients ont été examinés par moi-même, 9 par le Dr Alain Froidevaux et 5 par leurs médecins traitants.
Nous avons soumis les 44 patients revus à l'hôpital de La Gruyère à une anamnèse digestive complète et à un examen clinique.
L'hôpital de la Gruyère
Il s'agit d'un hôpital de 103 lits, composé d'un service de Chirurgie, d'un service d'Orthopédie, d'un service de Médecine Interne et d'une unité de Gynécologie-Obstétrique. D'autres sous-spécialités y sont régulièrement pratiquées.
Situé à Riaz, à 4 km de Bulle, dans le canton de Fribourg, il draine un bassin de population d'environ 50 000 personnes.
La majorité des patients viennent de la campagne et sont souvent agriculteurs. De type sédentaire, ils ne quittent que rarement leur région. Ils sont par ailleurs fidèles à leur médecin de famille, ce qui nous a permis de les retrouver facilement.
Le service de chirurgie
Au moment de ce travail, il est composé d'un médecin-chef (le Dr Alain Froidevaux), à la tête du service de Chirurgie depuis 1984, et de deux médecins assistants. Le service s'occupe de tous les cas de Chirurgie Générale, hormis les traumatismes osseux pris en charge par l'Orthopédie.
Depuis plus de dix ans, la grande majorité des cures d'éventration se font par mise en place d'une prothèse non résorbable et sont pratiquées exclusivement par le Dr Alain Froidevaux qui a l'habitude de ce type de chirurgie vu qu'il la pratiquait déjà depuis plusieurs années à l'Hôpital Cantonal de Genève. Dans ce travail, aucune courbe d'apprentissage n'est à prendre en compte.
Comme on le voit sur l'illustration ci-dessous (fig.1), le nombre d'interventions à l'Hôpital de La Gruyère pour cure d'éventration a considérablement augmenté en 10 ans.
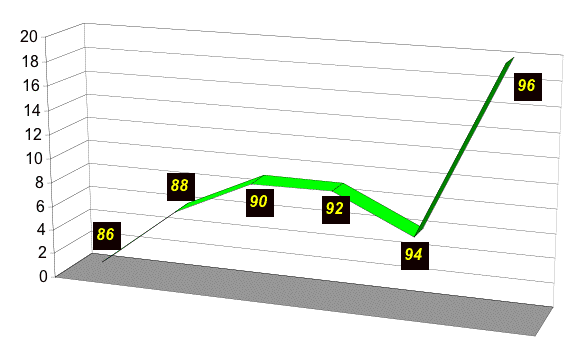 Fig. 1 : Evolution du nombre de cures d'éventration (n) en 10 ans, 1986-1996
Fig. 1 : Evolution du nombre de cures d'éventration (n) en 10 ans, 1986-1996
On peut expliquer ces chiffres ainsi :
D'une part, l'activité chirurgicale de l'hôpital s'est considérablement intensifiée ces dix dernières années passant de 200 interventions en 1985 à plus de 3000 en 1998, dont près de 200 laparotomies majeures.
Mais aussi, depuis 1986, le Dr A Froidevaux a consacré du temps pour sensibiliser le médecin traitant au problème de l'éventration et de son traitement. Car, faut-il le rappeler, l'éventration n'est pas une complication post-opératoire immédiate, elle survient souvent des années après l'intervention initiale. C'est le médecin traitant qui le premier sera consulté pour une éventration ou la diagnostiquera de manière fortuite. Il fallait se battre contre des idées reçues qui se basent sur d'anciens préceptes, tels que « 50% des cures d'éventrations récidivent », « une éventration n'est qu'un problème esthétique », « il s'agit d'une intervention majeure pour un bénéfice de loin pas garanti ».
En rendant attentif les médecins praticiens de la région (colloques, lettres didactiques) aux bénéfices que l'on peut tirer d'un filet posé dans de bonnes conditions, nous avons alors établi un vrai dialogue avec eux. Quand les médecins généralistes ont compris que l'éventration peut se grever de complications non négligeables, que le taux de récidive d'une cure d'éventration avec prothèse non résorbable était inférieur à 5%, ils ont commencé à nous adresser leurs patients porteurs d'une éventration, ce qui a contribué à nettement augmenter notre statistique opératoire en la matière.
L'indication opératoire
L'indication opératoire est toujours posée par le Dr A. Froidevaux. Le plus souvent, le patient lui est adressé par son médecin traitant.
Pour procéder à une cure d'éventration par mise en place d'un filet, il faut que le patient réponde à certains critères :
Indication
-
La qualité de la paroi est un des éléments les plus déterminants dans l'indication à poser un filet. En effet, une paroi affaiblie et atone, dont les structures musculo-aponévrotiques sont de mauvaise qualité et détendues, justifiera toujours, à notre sens, la mise en place d'une prothèse non résorbable, quelle que soit la taille de l'éventration. C'est le cas de tous les patients obèses.
-
Toutes les récidives seront traitées avec un filet, y compris les récidives de hernie de la ligne médiane.
-
Une éventration de grande taille (supérieure à 10 cm), ou avec defect de paroi, sera toujours traitée avec un renforcement pariétal non-résorbable.
-
Tout patient soumis à un travail physique très lourd, ce qui est très souvent le cas en Gruyère, doit bénéficier d'un renforcement prothétique. La majorité des patients, souvent agriculteurs indépendants, une fois sortis de l'hôpital, ne tiendront absolument pas compte des semaines nécessaires à la cicatrisation de la paroi. Par ailleurs, les patients commentent les résultats opératoires. Trop d'échecs répétés suffisent à « vider » un service hospitalier. Il importe donc de proposer un traitement fiable. Dans de tels cas, le filet reste certainement la meilleure alternative.
Contre-indications absolues ou relatives
-
Un filet de Mersilène® n'est jamais posé en terrain septique. Cela exclut quasi toutes les cures d'éventrations en urgence, sur incarcération par exemple.
-
Un filet n'est pas posé en position sous-ombilicale chez une femme jeune qui a encore des chances de procréer. En effet, la littérature est inexistante sur le sujet et nous ne prendrions jamais le risque d'entraver le déroulement normal d'une grossesse.
-
Le refus du patient de se faire poser un matériel étranger, ce qui est extrêmement rare, est aussi une contre-indication.
-
Une éventration de petite taille (souvent secondaire à un abcès de paroi) chez un patient dont la sangle musculo-aponévrotique est de bonne qualité.
-
Une malfaçon évidente lors d'une ancienne fermeture de laparotomie, lorsque la paroi est de bonne qualité.
Les résultats dans une cure d'éventration dépendent à nos yeux non seulement des modalités techniques de l'intervention elle-même, mais aussi des mesures d'accompagnement péri-opératoires.
Mesures périopératoires
Mesures préopératoires
La préparation opératoire des patients est primordiale et conditionne la qualité des résultats ultérieurs. Cette préparation comporte pour nous systématiquement :
-
Une préparation cutanée soigneuse. (savon antiseptique le soir précédant l'intervention).
-
Une préparation respiratoire qui, suivant l'évaluation clinique des cas, ira des simples exercices de respiration le jour précédant l'intervention (inspirex) à une physiothérapie respiratoire intensive pendant plusieurs jours.
-
La correction la plus parfaite des tares viscérales préopératoires (cure d'amaigrissement éventuelle, correction d'un diabète, etc.).
Antibiothérapie préopératoire (fig. 2)
Nous n'avons pas systématiquement utilisé d'antibiothérapie prophylactique chez nos patients opérés d'éventration par mise en place d'une prothèse prépéritonéale. Dix-neuf pourcents (n=10) n'ont en effet par reçu d'antibiotiques. Pour les autres, l'antibiotique de choix était une céphalosporine de deuxième génération administrée par voie parentérale ½ heure avant le début de l'opération. Dans 79,5% (n=35) des cas, nous avons opté pour de la Rocéphine® à raison de 2g et dans 20,5% (n=9) du Zinacef® à raison de 1,5 g. Dans la majorité des cas, l'antibiothérapie était poursuivie pendant les premiers jours, jusqu'à ablation des drains.
 Fig. 2 : Prophylaxie antibiotique chez nos patients (n=54)
Fig. 2 : Prophylaxie antibiotique chez nos patients (n=54)
Actuellement, la littérature propose une prophylaxie antibiotique systématique avant l'intervention, de préférence avec des céphalosporines de deuxième génération. C'est pourquoi nous avons recours maintenant à une antibiothérapie prophylactique chez tous nos patients opérés pour un renforcement pariétal prothétique.
Mesures peropératoires
Les mesures prophylactiques peropératoires nous semblent indispensables. La peau est rasée juste avant l'intervention afin d'éviter de petites abrasions cutanées qui peuvent se surinfecter en quelques heures, comme c'est le cas lors du rasage la veille de l'intervention. La désinfection est scrupuleuse (Betadine®) et étendue. Jusqu'en 1995, nous utilisions des champs en tissu, régulièrement stérilisés. Nous les avons abandonné au profit des champs à usage unique. L'asepsie pendant l'intervention est scrupuleusement respectée (nouveau champtage et changement de gants après dégagement du plan prépéritonéal et avant la manipulation de la prothèse). Le filet est trempé dans une solution de Betadine® avant la pose. Nous mettons en place deux drains de redons sous aspiration au contact de la prothèse afin d'éviter la formation d'hématomes et séromes suceptibles de s'infecter. En fin d'intervention, par les deux drains, nous injectons 200 ml d'une solution antiseptique de Taurolin® (taurolidinum), que nous laissons agir pendant 60 minutes avant d'ouvrir les drains.
Mesures postopératoires
Les mesures post-opératoires doivent de même être scrupuleuses. La mobilisation prudente au lit dans les premiers jours doit être préférée à un lever précoce trop énergique. En effet, jusqu'au 7e jour post-opératoire, la réparation pariétale est encore fragile, avec le risque de désinsertion de la prothèse au niveau de ses zones de fixation à la paroi (ce risque étant minimisé par l'implantation de prothèses débordant très largement les berges de l'éventration). Les complications locales post-opératoires, hématomes et collection périprothétiques (séromes), sont prévenues par un drainage juxta-prothétique de minimum 48 heures.
Le choix du matériel prothétique
Comme nous l'avons vu précédemment, diverses études expérimentales avec analyse histologique ont permis d'établir que le meilleur matériel prothétique est celui qui développe la plus forte activité fibroblastique. De plus, les prothèses ne doivent pas être imperméables pour ne pas risquer l'apparition de collections périprothétiques suceptibles d'infection. D'où l'utilisation préférentielle des prothèses à mailles représentées principalement par le Polypropylène (Marlex®, Prolène®) et le polyester (Mersilène®).
Pour notre part, et après plus de 3000 utilisations, nous sommes restés fidèles aux plaques de Mersilène® dont la fiabilité nous paraît parfaite et qui de plus présentent l'avantage d'un prix raisonnable. Par sa souplesse, le Mersilène® permet l'utilisation d'un filet de grande taille (30x30cm) qui s'insinue facilement dans tous les recoins du plan prépéritonéal. Le procédé « interlock » qui rend son démaillage impossible, et nous permet donc de le couper, est encore pour nous un argument supplémentaire pour le préférer aux autres prothèses.
L'emplacement de la prothèse
A nos yeux, la prothèse ne doit jamais être placée dans le plan sous-cutané, inutile du point de vue biomécanique et d'un risque infectieux prohibitif. Le contact direct avec les anses doit aussi être évité dans la mesure du possible, vu les risques non négligeables d'adhérences et de fistulisation aux organes creux. Il reste dans ce cas deux localisations : retrorectal et prépéritonéal. Les deux sont valables du point de vue biomécanique.
Retrorectal (Flamand)
Ce plan de clivage, décrit entre autres par Flammand est compris entre l'aponévrose postérieure et le corps musculaire du m. droit de l'abdomen. Cet espace n'existe qu'au niveau sus-ombilical. Dans ce cas, la dissection est aisée et permet l'insertion d'un filet relativement large, séparé des anses par un plan aponévrotique. Mais nous sommes limités dans l'expansion latérale du filet à moins d'inciser l'aponévrose de la décussation intermédiaire pour poursuivre la dissection entre le m.oblique interne et transverse (fig. 3).
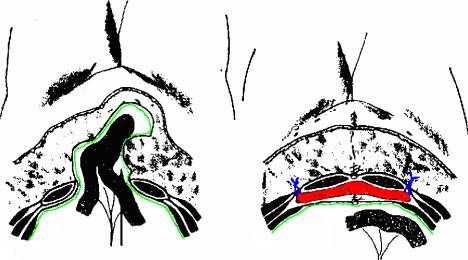 Fig. 3 : Dissection entre le m.oblique interne et transverse
Fig. 3 : Dissection entre le m.oblique interne et transverse
Prépéritonéal (Stoppa)
Ce plan de clivage est compris entre l'aponévrose postérieure du m. droit de l'abdomen et le péritoine. Le décollement est plus difficile et le sac péritonéal s'ouvre souvent à la dissection. Le filet n'est séparé des anses que par un film mince de péritoine pariétal. Cependant, la dissection de ce plan nous permet de dégager le sac péritonéal en un seul bloc et d'aller fixer le filet très latéralement sur l'aponévrose postérieure des muscles larges de l'abdomen. (fig. 4)
 Fig. 4 : Filet fixé très latéralement sur l'aponévrose postérieure des muscles larges de l'abdomen
Fig. 4 : Filet fixé très latéralement sur l'aponévrose postérieure des muscles larges de l'abdomen
Pour notre part, nous préférons la position prépéritonéale qui ne nous limite aucunement dans la dimension de la prothèse et qui, du point de vue biomécanique et restauration de la fonction des couples musculaires, nous semble la meilleure.
Dimension de la prothèse et fixation
La dimension de la plaque prothétique nous semble un élément important dans l'obtention du succès final. Nous avons pour règle d'utiliser une prothèse de grande dimension, débordant largement les berges de l'éventration, ce qui certes impose une dissection large et laborieuse, mais permet un ancrage solide de la prothèse. En effet, une prothèse de petite taille, simplement amarrée sur les berges de l'éventration, souvent scléreuses et atrophiques, expose à un risque de récidive non négligeable et doit être évitée.
Il apparaît prudent de fixer la prothèse et nous avons l'habitude de le faire par une série de points séparés (fil non résorbable) prenant largement le plan musculo-aponévrotique. Nous n'utilisons pas la technique des bourdonnets en raison des risques infectieux.
Déroulement opératoires et détails techniques
Nous ne l'avons pas changé depuis plus de dix ans, et tous les patients entrant dans cette étude ont été opérés selon la même technique, quel que soit le siège de l'éventration :
-
Excision de la cicatrice opératoire.
-
Incision jusqu'au sac herniaire.
-
Dégagement et réduction du sac herniaire de la paroi.
-
Trouver le plan pré-péritonéal.
-
Dissection de ce plan le plus largement possible.
-
Hémostase minutieuse.
-
Mise en place d'un filet de Mersilène® dans le plan pré-péritonéal.
-
Fixation des extrémités latérales du filet aux structures aponévrotiques des muscles larges par des points séparés de Mersilène 0®, de manière à ce qu'il soit posé sur le péritoine, sans être tendu, en évitant au maximum les plis, sources d'infection.
-
Mise en place de deux redons sous aspiration.
-
Fermeture de la paroi avec un surjet de Dexon 0®.
-
Fermeture de la peau avec un surjet donati en polypropylène.
-
Par les redons, remplissage de l'espace prépéritonéal avec 200 ml Taurolin 1% ®, et clampage des redons pendant 1 heure.
-
Déclampage des redons 1 heure plus tard.
Les patients
Sexe
-
24 femmes (44%)
-
31 hommes (56%)
Cette proportion est quelque peu différente de celle que l'on trouve habituellement dans la littérature. En effet, on note généralement 3 éventrations chez l'homme pour une chez la femme. Nous expliquons ces chiffres de la manière suivante. L'excès pondéral concerne les deux sexes en Gruyère, et touche souvent même plus la femme que l'homme. Mais aussi, la femme gruyérienne demeure astreinte aux mêmes travaux physiques que l'homme.
Âge
L'âge moyen des patients (fig. 5) chez lesquels nous avons pratiqué une cure d'éventration avec interposition d'un filet est de 53 ans, avec des extrêmes chez une femme de 84 ans dans le cas d'une récidive de hernie ombilicale avec risque d'incarcération et chez un homme de 30 ans porteur d'une volumineuse éventration sus-ombilicale après opération de Nissen.
 Fig. 5 : Age moyen du collectif de patients
Fig. 5 : Age moyen du collectif de patients
Recul
Nous avons recherché tous les patients opérés entre 1987 et début 1997. Nous avons exclu les patients opérés au-delà de cette date malgré leur nombre important pour respecter un temps de recul valable, ce qui est un paramètre capital dans ce type de travail. Le recul moyen est de plus de quatre ans, plus exactement 53,3 mois (n = 49). Comme le montre la figure ci-dessous (fig 6), les deux pics se trouvent à deux ans et entre 6 et 8 ans. Les deux extrêmes sont de 8 mois et 144 mois.
 Fig. 6 : Recul lors de l'examen clinique des patients (1998)
Fig. 6 : Recul lors de l'examen clinique des patients (1998)
Type d'éventration
Pour notre travail, nous avons traité les récidives de cure de hernie ombilicale et de hernie de la ligne blanche comme une éventration. En effet, le technique chirurgicale, comme l'indication opératoire, ne diffèrent pas dans les deux groupes.
Récidives de hernie de la ligne médiane
Sur 55 patients, 9 (16,3%) ont été opérés d'une récidive de hernie ombilicale et 4 (7,25%) d'une récidive de hernie de la ligne blanche.
Le nombre de femmes et d'hommes était pareil dans les deux groupes de récidive de hernie de la ligne médiane.
On obtient un recul moyen de 57 mois, avec des extrêmes à 120 et 10 pour la hernie ombilicale. Une patiente décédée n'a pas pu être prise en compte dans le recul et le travail final.
Pour les récidives de hernie de la ligne blanche, le recul moyen est de 25 mois avec des extrêmes à 11 et 29 mois. Une hernie ombilicale et une hernie de la ligne blanche ont été opérées en urgence lors d'incarcération grêle.
Éventrations (fig. 7)
Les 42 patients restants (76,3%) ont été opérés d'une éventration.
Dans ce groupe, 6 (14,3%) présentaient des éventrations récidivées, la plupart du temps après échec d'une cure classique.
Dans un cas, il s'agissait de la quatrième récidive d'éventration, chaque fois opérée par différentes cures, différents chirurgiens, et dont certaines avec mise en place de prothèses ; à noter que la prothèse n'a jamais été mise en arrière de la musculature, ni placée suffisamment latéralement pour permettre de bons points d'ancrage.
Toutes ces récidives étaient de siège médian. Trois (50%) d'entre elles étaient des laparotomies en urgence, et 3 (50%) concernaient l'estomac (1 Nissen et 2 Billroth II).
 Fig. 7 : Eventrations
Fig. 7 : Eventrations
Pour 36 patients, il s'agissait d'une première éventration.
On peut regrouper les laparotomies initiales de la sorte :
-
26 (72,2%) interventions étaient électives.
-
10 (27,7%) en urgence.
-
24 (66,7%) incisions étaient de siège médian, dont 12 (50%) étaient des incisions médianes sus-ombilicales.
Toutes les interventions en urgence, hormis une appendicectomie par incision selon Jalaguier, étaient des laparotomies exploratrices (n=9) dans le contexte d'un abdomen aigu.
-
3 (33,4%) d'entre elles ont motivé un acte sur un colon non préparé (1 hémorragie diverticulaire massive et 2 perforations sigmoïdiennes sur diverticulite aiguë dans un terrain de péritonite stercorale)
-
5 dans le contexte d'une souffrance grêle motivant une résection intestinale
-
1 laparotomie blanche au Maroc, avec pose d'une gastrostomie.
Nous avons voulu savoir si l'organe opéré pouvait avoir une incidence sur l'éventration. Le graphique ci-dessous (fig. 8) nous montre clairement une incidence anormalement élevée d'éventrations après une chirurgie sur l'estomac :
 Fig. 8A : Incidence des éventrations en fonction de l'organe opéré
Fig. 8A : Incidence des éventrations en fonction de l'organe opéré
En effet, 14 (34%) laparotomies, dont 7 (17%) Nissen pour hernie hiatale symptomatique, 5 (13%) Billroth II et 2 (5% ) sutures d'ulcère pour maladie ulcéreuse, se sont compliquées d'une éventration (fig 9). Seules deux d'entre elles ont été pratiquées en urgence.
Ces chiffres sont élevés. Si un ulcère perforé ou hémorragique est pris en urgence, nous savons que les risques d'éventrations sont augmentés. En revanche, la fundoplicature selon Nissen, qui est pratiquée de manière élective chez des patients en bon état général souvent d'âge moyen, ne devrait pas se compliquer d'une éventration dans de telles proportions. Même à l'époque, avant la commercialisation des inhibiteurs de la pompe à proton (omeprazol), la fundoplicature selon Nissen n'était de loin pas la laparotomie élective la plus fréquente d'un service de chirurgie viscérale.
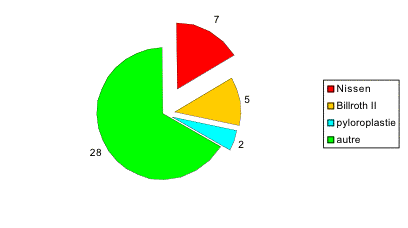 Fig. 8B : Proportions des interventions initiales touchant à l'estomac dans notre collectif d'éventrations (n=42)
Fig. 8B : Proportions des interventions initiales touchant à l'estomac dans notre collectif d'éventrations (n=42)
Nous expliquons ces valeurs de la manière suivante :
D'une part, l'incision pratiquée pour une cure de hernie hiatale est une médiane sus-ombilicale, qui remonte très haut, à la limite de l'appendice xiphoïde ; comme nous l'avons vu précédemment, la ligne blanche sus-ombilicale est beaucoup plus fragile que la ligne blanche sous-ombilicale.
D'autre part, en raison de la profondeur du champ opératoire et de la force nécessaire à écarter la paroi pour atteindre le hiatus oesophagien, une ischémie de compression peut être à l'origine de microtraumatismes de la paroi, qui en fragilisent sa cicatrisation.
Taille des hernies de la ligne médiane
Hernies ombilicales
-
5 (56%) dont le collet mesurait < 5 centimètres
-
2 (22%) dont le collet était compris entre 5 cm et 10 cm
-
2 (22%) dont le collet mesurait > 10 cm
Hernies de la ligne blanche
-
3 (75%) dont le collet mesurait < 5 cm
-
1 (25%), dont le collet mesurait > 10 cm
Taille des éventrations et typesd'incision
Taille des éventrations (fig. 9)
Dans notre collectif d'éventrations, seules 2 (4,7%) avaient un collet herniaire de moins de cinq centimètres. Pour le reste, 14 (33,3%) avaient un collet compris entre 5 et 10 centimètres et 26 (62%) étaient pluriloculées ou avaient un diamètre supérieur à 10 centimètres.
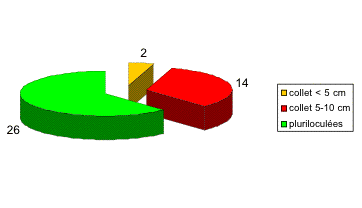 Fig. 9 : Taille des éventrations
Fig. 9 : Taille des éventrations
Type d'incision (fig. 10)
35 (84%) incisions étaient des laparotomies médianes fractionnées de la sorte :
-
15 (43%) étaient à cheval sur l'ombilic
-
14 (40%) médianes sus-ombilicale
-
6 (17%) médianes sous-ombilicales.
7 (16%) incisions ne concernaient pas la ligne médiane :
-
5 (9,5%) incisions de Pfannenstiel
-
1 (2,4%) incision paraombilicale
-
1 (2,4%) incision de lombotomie
-
1 (2,4%) incision selon Jalaguier
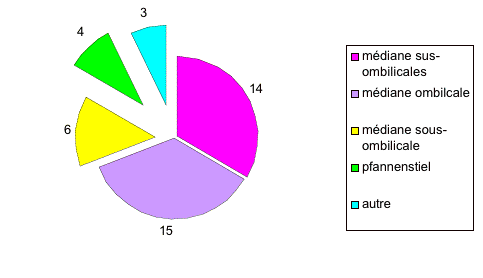 Fig. 10 : Répartition selon la localisation de l'éventration
Fig. 10 : Répartition selon la localisation de l'éventration
En conclusion, 35 (84%) éventrations étaient sur la ligne médiane, dont 29 (83%) d'entre au niveau de la ligne blanche sus-ombilicale.
Cela nous confirme que l'incision médiane, et plus particulièrement l'incision sus-ombilicale, se complique plus facilement d'une éventration que toute autre incision.
Comorbidités
Dans notre collectif de patients :
-
31 (56,3%) étaient ASA I
-
14 (25,5%) ASA II
-
10 (18,2%) ASA III.
| Tabl. 1 : Comorbidités pouvant avoir une influence sur les suites post-opératoires |
| |
Nb |
Pathologie |
| Système cardio-vasculaire |
12 |
- Hypertension Artérielle (8)
- Insuffisance cardiaque essentielle (2)
- Cardiopathie ischémique (2) |
| Système respiratoire |
7 |
- Syndrome obstructif chronique (3)
- Status après Syndrome de détresse respiratoire aiguë (2)
- Status après contusion pulmonaire (1)
- Status après empyème pulmonaire (1) |
| Uro-génital |
5 |
- Prostatisme (3)
- Insuffisance rénale chronique (2) |
| Métabolique |
3 |
- Diabète type II non insulinodépendant |
| Pathologie |
4 |
- Adenocarcinomecarcinome de l'utérus (2)
- Adenocarcinomecarcinome du colon (1)
- Carcinome de la prostate (1) |
D'autres comorbidités ne sont pas répertoriées, car bénignes, sans conséquence sur les suites opératoires.
Facteurs de risque ayant pu influencer la survenue d'une éventration
Infection postopératoire
Sur le total des éventrations (n=42), seules 4 (9,5%) des laparotomies initiales ont été pratiquées dans un terrain septique.
8 (19%) patients ont développé un abcès post-opératoire documenté:
-
7 abcès de paroi après la laparotomie (dont 4 après laparotomie pour péritonite)
-
1 abcès du cul de sac de Douglas (intervention non septique, gynécologique, par incision selon Pfannenstiel).
Surcharge pondérale
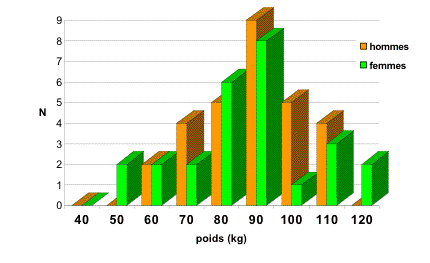 Fig. 11 : Poids en fonction du sexe
Fig. 11 : Poids en fonction du sexe
La majorité de la population gruyérienne souffre d'un excès pondéral, dû probablement aux habitudes alimentaires propres à la région. Dans notre collectif, la majorité des patients sont à la limite de l'obésité, voir même obèses, avec un BMI dépassant 30. Le tableau ci-dessous nous donne une idée sur l'excès pondéral global de nos patients.
Le poids moyen de la femme opérée est de 80.5 kg, avec des extrêmes à 44 kg et 116 kg. Aucune des femmes examinées ne dépassait 170 cm. Chez les hommes, le poids moyen est de 84.5 kg avec des extrêmes à 55 kg et 110 kg. Ces chiffres montrent bien que l'éventration touche avant tout les patients de corpulence obèse.
Urgence
13 (30%) des laparotomies qui ont entraîné une éventration ont été pratiquées dans des conditions d'urgence :
-
4 (31%) d'entre elles dans le cadre d'une péritonite stercorale (3 lésions coliques et une appendicite perforée),
-
3 (13%) dans le contexte d'un choc hémorragique (1 traumatisme hépatique, 1 hémorragie diverticulaire et 1 hématome rétropéritonéal),
-
5 (38%) pour iléus obstructif (iléus sur bride),
-
1 (8%) en péritonite purulente (perforation gastrique).
Une laparotomie médiane en urgence augmente considérablement l'incidence d'éventration. En effet, une laparotomie exploratrice a lieu le plus souvent dans le cadre d'un troisième secteur constitué ou des conditions septiques ; le temps d'intervention est plus long, les suites opératoires sont souvent plus compliquées.
Ces différents facteurs ajoutés les uns aux autres influencent obligatoirement la cicatrisation de la paroi.
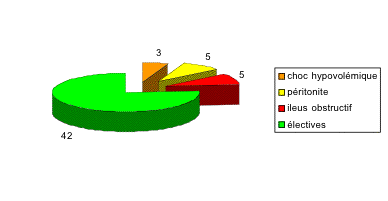 Fig. 12 : Type de laparotomie initiale
Fig. 12 : Type de laparotomie initiale
Autres facteurs
-
4 (9,5%) patients avec fistule entéro-cutanée. Dans 3 cas des suites d'un geste chirurgical en urgence, et dans un cas des suites d'une diverticulite aiguë perforée,
-
2 patients avec intubation prolongée pour décompensation respiratoire aiguë sur ARDS après laparotomie en urgence,
-
1 patient, opéré d'un pontage aorto-bifémoral, avec ischémie pariétale prolongée due au clampage aortique.
Temps opératoire de la cure herniaire avec renforcement pariétal prothétique
La dissection du plan prépéritonéal est longue et parfois difficile, en particulier en cas d'intervention antérieure, ce qui est toujours le cas dans ce travail.
Nous avons ici relevé les durées d'intervention pour les cures d'éventration et récidives de hernie de la ligne médiane. La durée opératoire est calculée depuis le « coup de bistouri » jusqu'à la fermeture de la peau. Elle est documentée grâce à la feuille d'anesthésie.
Récidive de hernie de la ligne blanche / hernie ombilicale
La durée opératoire moyenne d'une récidive de cure de hernie de la ligne médiane (hernie de la ligne blanche et hernie ombilicale) (n=13) est de 104 minutes, avec des extrêmes àde150 minutes (2 cas) et 60 minutes (5 cas).
Éventration
La durée opératoire moyenne est de 105 minutes pour les éventrations (n=42), avec des extrêmes de 180 minutes (2 cas d'éventration médiane) et 60 minutes (3 cas).
Sur la figure ci-dessous (fig. 13), nous constatons que le décollement de l'espace prépéritonéal prend du temps. En décidant de procéder à une cure de hernie pariétale par mise en place d'une prothèse dans le plan prépéritonéal, il faut compter au minimum une heure qui, suivant la difficulté du décollement, peut dépasser trois heures.
Une récidive de hernie de la ligne médiane ou d'éventration prend en moyenne le même temps opératoire.
Nous avons essayé de confronter les différents temps opératoires en fonction d'autres critères, comme le poids des patients, la taille de l'éventration, le site de l'éventration ou encore le caractère récidivant de l'éventration. Aucune différence n'est statistiquement significative.
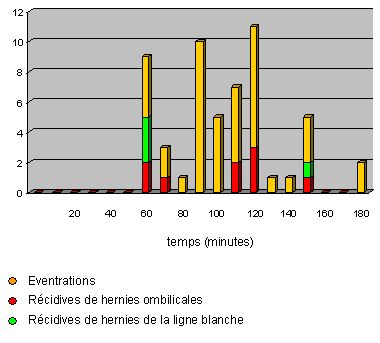 Fig. 13 : Durée opératoire des cures d'éventration (n)
Fig. 13 : Durée opératoire des cures d'éventration (n)
En conclusion, cette dissection est le plus souvent individuelle. L'espace prépéritonéal pourra se décoller facilement chez un patient obèse, opéré à plusieurs reprises, alors qu'il sera adhérent à la paroi chez un patient mince, et très difficile à séparer de l'aponévrose postérieure des droits.
Durée de l'hospitalisation
Le patient gruyérien, et plus particulièrement les agriculteurs, n'ont aucune compliance quant aux recommandations habituelles faites après une cure d'éventration avec pose de matériel prothétique. Nous savons pertinemment qu'un travailleur de force indépendant, une fois rentré à domicile, n'hésitera pas à se mettre à torse nu et soulever de lourdes charges pour pouvoir exploiter son domaine. C'est pourquoi, suivant les cas, nous préférons garder certains patients hospitalisés quelques jours supplémentaires, en tout cas jusqu'à fermeture de la plaie opératoire. Néanmoins, actuellement, nous tendons à diminuer cette durée d'hospitalisation.
Récidive de hernie ombilicale / hernie de la ligne blanche
-
Les patients opérés de récidive de hernie ombilicale ont séjourné en moyenne 13 jours avec des extrêmes de 22 jours (2 patients classés ASA III au moment de l'intervention) et 5 jours (dans deux cas).
-
Les patients opérés d'une récidive de hernie de la ligne blanche ont séjourné en moyenne 8 jours avec des extrêmes de 11 et 5 jours.
Éventration
-
Les patients opérés d'éventration ont séjourné en moyenne 10 jours dans notre service avec des extrêmes de 9 et 23 jours.
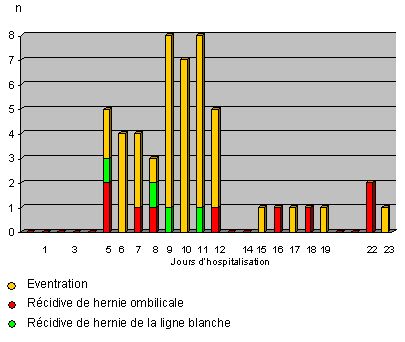 Fig. 14 : Durée d'hospitalisation après cure d'éventration
Fig. 14 : Durée d'hospitalisation après cure d'éventration
En conclusion, nous avons une durée d'hospitalisation moyenne de 10,36 jours. Les hernies ombilicales récidivées restent en moyenne 3 jours de plus que les patients opérés d'une éventration. Les durées d'hospitalisation sont en relation avec le type d'activité du patient, sa compliance, mais aussi avec les comorbidités associées qui seront développées plus loin.
Complications postopératoires
Nous ne relatons aucune mortalité periopératoire.
Complications systémiques
Sur nos 55 patients :
-
43 ont eu des suites parfaitement simples.
-
12 (27,27%) ont fait des complications post-opératoires documentées plus ou moins graves:
-
6 (54,5%) ont fait des complications pulmonaires réparties comme suit :
-
ZZZIci commence un troisième degré de liste à puces :
-
3 pneumonies
-
1 broncho-aspiration
-
1 atélectasie
-
1 embolie pulmonaire.
-
ZZZIci fini le troisième degré de la liste
-
2 rétentions urinaires aiguës et prolongées, l'une sur l'anesthésie rachidienne, l'autre sur prostatisme
-
1 iléus paralytique prolongé
-
1 entérite bactérienne aiguë
-
1 crise d'angor
-
1 polyurie mise sur le compte d'un syndrome d'inhibition de la sécrétion d'hormone anti-diurétique (SIADH), qui s'est spontanément résolu mais qui a nécessité 23 jours d'hospitalisation.
Aucune de ces complications n'a laissé de séquelles dès le retour à domicile du patient.
Comme on peut le voir, plus de la moitié des complications systémiques sont d'origine pulmonaire, et pour 5 (83,3%) d'entre elles en relation avec le type d'intervention.
Dans ces 5 cas, les complications pulmonaires faisaient suite à une cure d'éventration médiane. En effet, en mettant un filet de grande taille, nous provoquons une augmentation de la pression intraabdominale qui produit un syndrome restrictif transitoire pendant quelques jours, ce qui augmente les risques de broncho-aspiration, de pneumonie et d'atélectase. C'est pourquoi, nous sommes toujours très prudents avec la réalimentation et mettons le patient au bénéfice d'une physiothérapie respiratoire intensive dans les premiers jours post-opératoires.
Complications pariétales
On dénombre 5 complications touchant la paroi :
-
2 nécroses cutanées bénignes, ne nécessitant pas de geste chirurgical
-
1 abcès de paroi et 1 sérome, tous deux chez la même patiente, qui ont du être drainés en salle d'opération
-
1 hématome surinfecté a également nécessité un drainage chirurgical
Aucune de ces complications n'a eu de répercussion sur l'incorporation du filet, qui était en position prépéritonéale, car toutes ces complications ont eu lieu en avant de la musculature des droits (peau et tissu sous-cutané).
Infection du filet
-
1 infection du filet chez un patient opéré à l'âge de 40 ans d'une éventration médiane sus-ombilicale, consécutive à un Nissen.
Le patient était classé ASA I, n'avait pas de comorbidité et pesait 80 kg pour 170 cm (BMI de 28 [kg/cm2]). L'intervention avait duré 105 minutes et n'avait pas posé de problème technique particulier.
En revanche, nous n'avions pas fait de prophylaxie antibiotique, pas de rinçage au Taurolin®, et usé à l'époque de champs en tissu.
Les suites opératoires avaient été simples et afébriles et le patient avait pu quitter notre service de chirurgie au sixième jour post-opératoire. C'est au dixième jour qu'il commence à présenter un état fébrile, associé à des douleurs abdominales. Il consulte alors les urgences d'un hôpital voisin, qui diagnostique une infection de la prothèse et procède à son ablation en urgence. Nous n'avons jamais été au courant de cette infection jusqu'à la convocation du patient pour notre étude.
Examen clinique des patients
Nous avons contacté 46 patients susceptibles d'être revus, et 42 ont accepté de venir à l'hôpital de Riaz pour anamnèse et examen clinique. Dans le cas des 4 patients qui ont refusé, nous avons pu communiquer par téléphone, et aucun n'avait de plainte, ni ne décrivait de récidive ; nous avons complété les informations manquantes, et en particulier l'examen clinique en contactant leur médecin traitant qui a examiné les patients à notre place.
Nous avons en tout pu enregistrer les données des 46 patients et suivre 49 cures d'éventration / récidive de hernie de la ligne médiane par mise en place d'un filet de Mersilène® en position prépéritonéale, avec un recul moyen de 53,3 mois.
3 patients ont été opérés de deux éventrations différentes :
-
1 éventration sur incision de Pfannenstiel et une éventration médiane.
-
1 éventration médiane et 1 éventration sur lombotomie.
-
1 éventration sous-ombilicale et 1 éventration sus-ombilicale.
Dans ces trois cas, la deuxième éventration avait lieu après une nouvelle laparotomie (2) ou lombotomie (1), en dehors des limites du filet posé antérieurement.
Cela montre bien qu'une éventration n'est pas toujours acquise et qu'il existe des susceptibilités individuelles à développer une éventration.
Anamnèse
Nous avons commencé l'examen par une anamnèse digestive complète chez nos 46 patients.
-
Chez tous sans exception, le transit est resté le même, on ne note pas d'anorexie, pas de perte d'appétit, pas de nausées, pas de vomissements.
-
Six se sont plaint d'une sensation subjective d'oppression de la ceinture abdominale, se traduisant chez 5 d'entre eux par un pyrosis anamnestique, non présent avant l'intervention. Ces derniers avaient été opérés d'une éventration médiane ou médiane sus-ombilicale.
-
Chez l'un d'entre eux, ce pyrosis était constant, et très handicapant. Déjà opéré d'un hémi-Nissen dans un autre établissement lors de l'intervention initiale, nous avons demandé une gastroscopie. L'examen a montré qu'il souffrait d'une oesophagite de reflux sévère sur récidive de hernie hiatale, ne cédant pas avec un traitement d'oméprazol ; il a subi une opération de Nissen par laparotomie quelques mois plus tard, sans succès probant.
-
Deux patients présentant une récidive clinique d'éventration, lombaire pour l'un et médiane pour l'autre (après ablation du filet qui s'était infecté), sur lesquels nous reviendrons plus loin, se sont plaints de douleurs et de gêne intermittentes au niveau de la cure d'éventration.
-
Un seul patient, sans complications post-opératoires, sans signe de récidive à l'examen clinique, s'est plaint de douleurs pariétales, parfois gênantes, au niveau de l'emplacement du filet.
Il avait été initialement subi une opération d Billroth II de manière élective, qui s'était compliqué d'un syndrome de détresse respiratoire aiguë (ARDS) motivant une intubation de plusieurs jours. La cure d'éventration sus-ombilicale de grande taille s'était déroulée sans problème. Dans ce cas toutefois, nous ne pouvons pas mettre les plaintes uniquement en rapport avec la cure d'éventration, ces dernières étant non systématisées, chez un patient déjà marqué par les complications dont il avait été victime lors de son opération gastrique.
-
Les 44 autres patients, sans exception ne présentaient aucune plainte douloureuse ou gêne au niveau de leur paroi.
-
Nous leur avons demandé s'il leur arrivait de sentir leur filet. Ils nous ont tous répondu par la négative. La majorité a même rajouté qu'ils se sentaient rassurés par le renforcement prothétique de leur paroi abdominale.
-
De manière générale, les patients n'ont pas vécu la cure d'éventration comme une intervention majeure, surtout en comparaison avec l'intervention initiale.
-
Trente-quatre patients ont pu nous répondre sur le nombre de semaines nécessaires pour reprendre leurs activités physiques normales :
-
2 (5,88%) ont pu reprendre leurs activités après moins de deux semaines
-
12 (35,29%) après 3 semaines
-
9 (26,47%) après 4 semaine
-
11 (32,35%) après 6 semaines.
Dans ce dernier groupe, 10 (90,9%) ont subi des cures d'éventration, alors que dans les autres groupes, jusqu'à 4 semaines, dans 43,3% des cas, il s'agissait de patients opérés d'une récidive de hernie de la ligne médiane. Une seule cure de récidive de la ligne médiane a empêché le patient pendant plus de 6 semaines à retrouver des activités normales.
-
Sur le collectif total (n=46), 3 patients (6,52%) admettent que leur activité habituelle s'est vue diminuée après l'intervention ; pour 2 d'entre eux, cette diminution est en relation directe avec une récidive diagnostiquée à l'examen clinique. La dernière patiente, opérée d'une récidive de hernie ombilicale, attribue cette diminution d'activité à la peur d'une nouvelle récidive.
-
Sur les 46 patients questionnés, seul un, celui dont le filet s'est infecté, regrette l'intervention et ne se ferait plus opérer. Tous les autres ne regrettent pas l'intervention (les interventions pour 3 d'entre eux) et, au besoin, se feraient opérer à nouveau.
Examen physique
Nous avons nous-mêmes procédé à un examen clinique de l'abdomen chez 44 patients et 3 médecins traitant chez 5 patients. Les chiffres diffèrent du groupe précédent car un examen clinique à la recherche d'une récidive avait été fait avant le décès de 3 patients.
Nous avons commencé l'examen en demandant au patient de procéder à un Valsalva en position debout, complété ensuite par un examen en décubitus dorsal, avec flexion de l'abdomen. Nous avons été particulièrement attentifs à tout élément suspect de récidive, se manifestant par une voussure impulsive à l'augmentation de la pression abdominale ou à la palpation d'un défect de la paroi. Nous avons examiné les orifices herniaires chez tous nos patients.
Nous avons pu analyser ainsi les données cliniques chez 49 patients ayant subi entre tous 52 cures d'éventration / récidive de hernie de la ligne médiane.
On relève les résultats suivants :
-
2 récidives chez des patients opérés de cure d'éventration par renforcement prothétique
-
0 récidive chez les patients opérés d'une récidive de hernie de la ligne médiane par renforcement prothétique
On dénombre donc 2 récidives (3,8%) pour 52 cures d'éventrations / récidives de hernie de la ligne médiane par interposition d'un filet de Mersilène® de grande taille en position prépéritonéale.
Développement des cas de récidive
1er cas : récidive d'une cure d'éventration lombaire sur un filet de trop petite taille
Le patient avait subi une lombotomie droite pour néphrectomie d'un rein atrophique, non fonctionnel et douloureux. Quelques semaines plus tard, il avait développé une éventration sur sa cicatrice de lombotomie.
Le patient est de corpulence normale, avec un BMI à 25 [kg/cm2].
Il a été opéré de son éventration de lombotomie en 1995 avec mise en place d'un filet de Mersilène® en position prépéritonéale.
Quelques mois plus tard, il présente une récidive de hernie ombilicale (cure par fermeture simple de l'orifice), qui est opérée par renforcement pariétal prothétique.
Après ce renforcement prothétique, le patient commence à présenter des douleurs progressives au niveau de la cure d'éventration lombaire, accompagnées d'une voussure.
Lors de sa convocation, il me fait part de son problème. Il est présenté au Dr A. Froidevaux qui pose l'indication opératoire. Le patient est opéré en fin 1997 : en peropératoire, nous sommes tombés sur le filet précédent qui était de trop petite taille et qui était éventré ; dans ces conditions, nous avons procédé à un décollement étendu du plan prépéritonéal, mis un nouveau filet de 30 x 30 cm que nous avons amarré en haut sur les côtes, en arrière sur les processus transverses des vertèbres et en bas sur la crête iliaque ; à noter que nous avons préféré mettre nos points de fixation sur les structures musculo-aponévrotiques charnues que l'on trouve à proximité des éléments osseux pour éviter des douleurs post-opératoires résiduelles, rebelles et persistantes, que l'on trouve fréquemment en cas d'amarrage sur le périoste. Les suites ont été simples.
En 1998, le patient est revenu en consultation pour éventration d'une incision sous-costale droite (antécédent de cholécystectomie).
Il est à nouveau opéré de cette troisième éventration avec un troisième renforcement prothétique ; pendant ce séjour hospitalier, il présente une hernie inguinale droite d'apparition soudaine, motivant encore une cure avec un quatrième filet de Mersilène® .
Aux dernières nouvelles (décembre 1999), le patient se porte bien. Son hémiabdomen droit est ficelé par quatre filets de Mersilène® reliés les uns aux autres, et prenant appui sur la ligne blanche, le rebord costal inférieur, la colonne lombaire et l'os iliaque.
Ce cas illustre bien que certains patients souffrent d'une faiblesse de paroi telle que nous devons la traiter par un renforcement prothétique étendu (4 filets de Mersilène® dans ce cas), prenant appui sur des structures très solides.
Il faut garder à l'esprit que la pose d'un filet de grande taille renforce considérablement la paroi et provoque une augmentation de la pression intra-abdominale susceptible d'entraîner une hernie aux niveaux des autres points de faiblesse de la paroi.
2ème cas : récidive après ablation d'un filet infecté
Nous avons déjà parlé de ce cas précédemment. En effet, il s'agit du patient victime d'une infection de son filet posé suite à une éventration médiane, enlevé en urgence 2 semaines plus tard.
Au moment de l'examen, il présente depuis plusieurs années une douleur intermittente, parfois très gênante, au niveau de l'ombilic. Au status, on constate une récidive d'éventration d'environ 5 cm, périombilicale, très douloureuse à la palpation.
Le patient a été mis au courant du diagnostic.
Vu les complications dont il a été victime, il préfère refuser tout geste thérapeutique.
Leçon
Dans le premier cas il s'agit d'une erreur tactique sur un type d'éventration déjà très difficile à traiter, et dans le deuxième cas d'un accident qu'il faut impérativement prévenir.
Hernie ou éventration d'autre localisation après renforcement pariétal prothétique
1er cas : hernie de la ligne blanche sus-ombilicale après renforcement pariétal de l'étage abdominal inférieur
Il s'agit d'une patiente de 1920, en surcharge pondérale, opérée en 1990 d'une éventration médiane sous-ombilicale.
Comme la ligne blanche sus-ombilicale était intacte, un filet prépéritonéal de grande taille a été posé en position ombilico-pubienne.
Lors de la consultation, la patiente ne se plaint d'aucune douleur ; en revanche, à l'examen clinique, on constate une voussure sus-ombilicale, en amont de l'incision, indolore et parfaitement réductible.
Dans ce cas, il s'agit plutôt d'une hernie de la ligne blanche sus-ombilicale secondaire à la pose d'un filet qui a renforcé l'étage sous-ombilical aux dépens de la ligne blanche sus-ombilicale, dont la faiblesse s'est révélée avec l'augmentation de la pression intra-abdominale.
Vu l'âge de la patiente, le côté asymptomatique de cette hernie et l'absence de répercussions respiratoires, nous avons renoncé à opérer la hernie.
2ème cas : éventration d'une laparotomie double sous-costale après cure de récidive de hernie ombilicale par renforcement prothétique ne prenant pas l'intégralité de la ligne blanche
Il s'agit d'une patiente de 1933, opérée en 1987 d'une récidive de hernie ombilicale par renforcement prothétique.
Quelques années plus tard, elle subit une intervention au niveau de l'estomac par incision double sous-costale.
A l'anamnèse, la patiente est asymptomatique. En revanche, elle présente une volumineuse éventration double sous-costale de plus de 10 cm de diamètre, parfaitement réductible, et indolore à la palpation.
Pour l'instant, vu l'absence de symptomatologie douloureuse, elle préfère l'abstention chirurgicale.
Leçon
-
Au total, nous avons mis en évidence une éventration de l'étage sus-ombilical de nouvelle localisation dans 3 cas décrits plus haut.
-
Dans 4 autres cas, nous avons pu constater un diastasis de la ligne blanche sus-ombilicale en amont du rebord supérieur du filet, sans répercussions fonctionnelles.
-
Donc, sur 52 cures, 7 nouvelles éventrations (3) ou déhiscence de paroi (4) se sont développées suite à une cure par renforcement prothétique.
-
Toutes étaient localisées au niveau de la ligne blanche sus-ombilicale.
-
On sait que la ligne blanche sus-ombilicale est plus fragile, et que chez 30% de la population il manque une rangée de décussation médiane, ce qui la fragilise encore.
-
On sait aussi qu'un filet, surtout s'il est posé en position médiane, renforce la sangle abdominale et augmente la pression intra-abdominale, dont la force s'exerce principalement au niveau de l'étage sus-ombilical. Dans pareil cas, le risque de développer une hernie de la ligne blanche sus-ombilicale est élevé.
C'est pourquoi, si les fonctions respiratoires le permettent, nous préconisons, surtout après ce travail, de monter en position médiane le plus haut possible, sans toutefois fixer le filet au niveau des côtes, ce qui entraîne des douleurs.
Conclusion
Actuellement, il ne fait plus de doute qu'un renforcement prothétique de la paroi abdominale est le traitement de choix pour la grande majorité des éventrations.
En 2000, The New England Journal of Medicine a d'ailleurs publié le travail deLuijendijk [18] qui confirme la supériorité des cures avec renforcement prothétique non résorbable aux techniques classiquement pratiquées il y a encore quelques années.
Les chirurgiens suisses l'ont bien compris, vu que près de 90% d'entre eux utilisent un filet non résorbable dans la plupart de leurs cures d'éventration, comme nous avons pu le montrer en 1998 lors d'un questionnaire envoyé à tous les chirurgiens de suisse romande.
Avec 4% de récidive à l'examen clinique et un recul moyen de 4 ans, sans complication majeure à long terme, nos résultats sont meilleurs que ceux de la littérature en général. Cela s'explique ainsi : la technique adoptée était celle préconisée par de grands spécialistes de la pariétologie, mais surtout l'opérateur était toujours le même, et rompu à ce type de chirurgie.
Nous pouvons comparer ces résultats à ceux d'un travail semblable fait en 2000 à l'Hôpital Universitaire de Genève. Le nombre de patients était comparable et recruté de la même manière, opérés entre 1994 et 1995, mais les techniques et les opérateurs étaient différents. Les récidives après 5 ans étaient de 32% à l'examen clinique, sans différence notable entre une cure classique et avec filet. Toutes les cures prothétiques récidivées étaient dues à un filet de trop petite taille.
Un filet doit être posé en suivant certaines règles très strictes, visant à restaurer la fonction de la paroi abdominale. Si ces dernières ne sont pas respectées, le taux de récidive rejoint celui d'une cure classique, avec en plus les risques liés à l'incorporation d'un corps étranger.
En conclusion, la cure d'éventration est une chirurgie longue et difficile. Son succès dépendra de l'expérience de l'opérateur, de la technique utilisée et de la taille du filet.