La division asymétrique de certaines bactéries enfin comprise
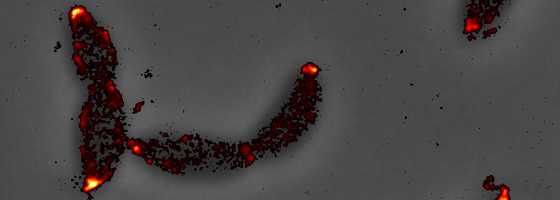
©Laboratoire Viollier – UNIGE. La microscopie en fluorescence à super résolution montre la protéine bipolaire ZitP (coloré en jaune) dans les cellules de Caulobacter crescentus
Chez les α-proteobactéries, un module conservé de deux protéines régissent ensemble la polarisation cellulaire et la division asymétrique. Certaines cellules, comme les cellules souches par exemple, se divisent de manière asymétrique, permettant ainsi à leurs cellules-filles de remplir des fonctions différentes. Mais comment se déroule la division asymétrique ? Quels sont les mécanismes cellulaires à l’œuvre ? En étudiant la bactérie aquatique Caulobacter crescentus, l’équipe de Patrick Viollier, professeur à la Faculté de médecine de l’Université de Genève (UNIGE), décrypte le rôle joué par une protéine nouvellement identifiée, ZitP, qui est capable de former différentes nanostructures en fonction du pôle où elle se situe, participant ainsi à la polarisation cellulaire nécessaire à une division asymétrique. Leurs résultats, à lire dans deux articles de la revue Elife, montrent de plus que ce mécanisme de polarisation existe également chez les rickettsies, des bactéries pathogènes intracellulaires obligatoires. Cette découverte permet d’obtenir des résultats préliminaires sur la polarisation de ces mystérieuses bactéries et potentiellement d’envisager un nouveau moyen de lutte contre ces bactéries.
Les scientifiques savent déjà que la division asymétrique est fortement liée à la polarisation des cellules concernées. La diversité cellulaire est en effet générée par l’action de protéines régulatrices situées aux pôles de la cellule. Celles situées à un pôle sont héritées par une cellule-fille, alors que celles à l’autre pôle le sont par l’autre cellule-fille. L’asymétrie cellulaire est donc intrinsèquement liée à la polarisation cellulaire. Afin d’étudier les déterminants de la polarisation cellulaire et d’identifier les protéines qui jouent un rôle dans cette différenciation de polarité, et qui par là-même en contrôlent la régulation, Patrick Viollier et son équipe se sont concentrés sur une bactérie modèle, Caulobacter crescentus, ayant des manifestations particulièrement visibles de cette polarisation. Cette bactérie a en effet la particularité de se diviser de manière asymétrique pour donner naissance à deux cellules-filles très différentes l’une de l’autre: la première est équipée d’un flagelle lui permettant de nager et d’explorer son environnement mais est incapable de se diviser, tandis que la seconde n’est pas motile mais peut continuellement se diviser.
Une protéine, deux fonctions
Avant d’effectuer sa division asymétrique, Caulobacter crescentus doit accumuler différents jeux de protéines à chaque pôle de la cellule. ZitP, une protéine polaire que l’équipe du professeur Viollier vient d’identifier chez Caulobacter crescentus, est impliquée dans le développement d’un appendice spécifique (pilus) à la cellule à flagelle, qui ne se retrouve pas dans l’autre cellule-fille. «Mais nous avons eu la surprise de découvrir cette protéine aux deux pôles, et non à un seul comme nous nous y attendions. Cette protéine est donc capable d’endosser deux fonctions distinctes, selon le pôle,» indique Patrick Viollier. Les scientifiques genevois ont compris pourquoi : ZitP forme des nanostructures à chaque pôle lui permettant de spécialiser sa fonction et de changer notamment ses interactions protéiques. « Grâce à des techniques d’imagerie par fluorescence, nous avons ainsi pu observer que la même protéine organise plusieurs structures, et s’exprime donc différemment selon le type de cellule-fille concerné et selon sa position sur la surface de la cellule. Les protéines parviennent, d’une certaine manière, à savoir, selon leur position, quelles fonctions elles doivent assurer, » explique Mathieu Bergé, premier auteur de ces travaux. A un pôle, ZitP va jouer le rôle d’un facteur de polarité permettant la mise en place d’une organelle (pilus), tandis qu’à l’autre pôle, ZitP va s’associer PopZ, une protéine clé pour l’établissement de la polarité cellulaire chez les α-protéobactéries, afin de contrôler sa localisation au cours du cycle cellulaire.
Un système polarisé identique dans d’autres bactéries
En utilisant ces deux protéines ZitP et PopZ, l’équipe du professeur Viollier est parvenu à reproduire le système de polarisation identifié chez C. crenscentus dans un système hétérologue - E. coli - qui est normalement non polarisé, prouvant ainsi que ces deux protéines combinées constituent le système minimal de polarisation. De plus, les microbiologistes ont montré que ce système de polarisation minimum est aussi présent et fonctionnel chez des rickettsies, une bactérie pathogène intracellulaire obligatoire - autrement dit qui ne peut vivre et se diviser qu’à l’intérieur d’une cellule eucaryote - à l’origine de bon nombre de maladies. En comprenant les déterminants moléculaires nécessaires à l’établissement de ce système de polarité minimal, ils ont aussi découvert comment le désactiver et interrompre le cycle cellulaire, ce qui permet d’imaginer de nouvelles stratégies de lutte contre ces bactéries et les dangers qu’elles représentent. «Nous avons établis une preuve de principe», conclut Patrick Viollier. «Nous devons maintenant chercher à comprendre comment ces deux protéines combinées parviennent à détecter les pôles cellulaires, et établir comment exploiter ces mécanismes contre des bactéries pathogènes».
Références:
http://dx.doi.org/10.7554/eLife.18647
http://dx.doi.org/10.7554/eLife.20640
30 déc. 2016
