Tuberculose : un siège éjectable pour disséminer l'infection ?
Des chercheurs genevois ont probablement identifié un des mécanismes qui permet la dissémination du bacille de la tuberculose d’une cellule à l’autre de l'organisme infecté. Le processus proposé implique une action concertée de l'agent pathogène et de son hôte sous forme d'un "siège éjectable" particulièrement efficace. L'étude a été publiée vendredi 27 mars 2009 dans la prestigieuse revue Science.
Mycobacterium tuberculosis. Cette bactérie malfaisante est responsable de 5-10 fois plus de décès sur la planète (1.5 millions/an; OMS) que le médiatique virus de la rougeole, et les autorités sanitaires ne diposent pas d’une arme aussi efficace qu’un vaccin pour l‘éradiquer. Au contraire, on assiste à une résurgence de cette infection et à une explosion des bacilles résistants aux antibiotiques. De plus, la découverte d’un traitement efficace est fortement ralentie en raison des zones d'ombre qui planent encore sur les modes d'action du pathogène.
En effet, alors que ses mécanismes d’invasion et de détournement des cellules immunitaires du poumon sont bien connus, la bactérie reste discrète sur la stratégie qu'elle adopte ensuite pour répandre son fatal venin vers les cellules immunitaires encore saines d'un organisme contaminé, condamnant ce dernier à plier sous l'assaut.
C'est là qu'intervient l'équipe du Dr Thierry Soldati, biochimiste à l'Université de Genève spécialisé dans l'étude des relations hôte-pathogène. En collaboration avec des confrères de l'Université de Cornell (USA), les chercheurs ont établi l'amibe Dictyostelium, un unicellulaire commun et inoffensif, comme modèle idéal pour résoudre l'énigme de la dissémination intercellulaire. En effet, ils ont montré que le cours de l’infection par les Mycobacterium pathogènes dans l’amibe est étonnamment similaire à celui suivi lors de l’infection des macrophages humains. Cela n’est en fait pas si surprenant si l’on considère que les protozoaires ont servi de terrain d’entraînement aux pathogènes durant des millions d’années, bien avant que certains ne se spécialisent à l’homme.
En tirant avantage d'une large palette de techniques modernes de génétique, de marquages fluorescents ultra-sélectifs et d'analyses microscopiques, les chercheurs genevois ont réussi le pari de suivre étape par étape le voyage de la souche infectieuse dans l'amibe-hôte, avec une attention toute spéciale pour les escales finales en territoire inconnu.
Les biochimistes se sont d'abord assurés que la bactérie tuberculeuse pénètre furtivement sa proie unicellulaire selon les mécanismes déjà connus, puis qu'elle crée sa niche de développement et de réplication, protégée par une vacuole. Durant ces phases d'infection et de prolifération, l'imposteur opportuniste parvient à détourner l'attention de l'hôte en exploitant ses ressources. Le processus passe inaperçu pour l'amibe, qui ne peut enclencher ses défenses immunitaires intrinsèques contre l'intrus et fournit même le matériel de construction de la vacuole.
Cet acte de piratage à l'échelle microscopique ne s'arrête pas là, et c'est moins de deux jours après l'infection que l'armée fraîchement levée de Mycobacterium entreprend d'achever son travail et de conquérir le monde, en d'autres termes de se disperser à l'extérieur de la cellule-hôte et d'infecter les cellules voisines, pour y recommencer son travail de sape.
A leur grande surprise, les chercheurs ont constaté que le processus de dissémination des bactéries ne se déroule pas aux dépens de l'innocente amibe, mais bien en concertation avec cette dernière.
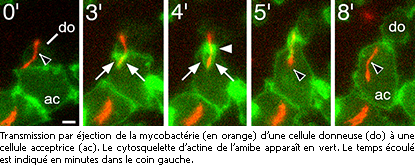
Lorsque les bactéries répliquées sont prêtes à l'assaut, la vacuole protectrice cède et libère les parasites dans l’espace intérieur de la cellule-hôte. Lorsque le bacille contacte la surface interne de la membrane de la cellule-hôte, elle induit la production de filaments d’actine, détournant cette protéine de son rôle usuel dans l'architecture et les mouvements des cellule eucaryotiques.
Les bactéries, ayant anesthésié la vigilance de l'amibe, se drapent d'actine tout en perçant la paroi membranaire de l'hôte. Durant ce processus subtil, l'assemblage intime membrane-actine-bactérie se transforme en une sorte de "siège éjectable", que les chercheurs proposent d'ailleurs de nommer éjectosome.
La microscopie révèle à cette ultime étape du voyage que les bactéries se faufilent à travers une sorte de septum et se disséminent hors de l’hôte tout en y abandonnant l'actine dont elles se sont servies pour s’en extraire. Peu rancunière, l'amibe utilise cette actine pour auto-réparer sa paroi membranaire percée, comme si rien ne s'était passé.
Les chercheurs genevois suggèrent que ce mécanisme concerté entre bactérie-pirate et cellule-hôte est mutuellement bénéfique, car le bacille laisse intact son réservoir de prolifération, et l’amibe épargnée peut retourner à sa vie de prédateur des sols forestiers.
Cette étude illustre que la recherche biomédicale, en accord avec les principes 3R de Réduction, Réforme, et Remplacement de l’expérimentation animale, sait se servir de modèles non animaux performants pour faire progresser la compréhension de maladies qui frappent l’humanité.
Les résultats de cette étude fondamentale menée sur un modèle rudimentaire de cellule ne sont certes pas directement exploitables pour enrayer la tuberculose chez l'Homme. Ils jettent cependant un éclairage totalement nouveau, que la revue internationale Science consacre, sur le processus de dissémination de la bactérie pathogène hors de sa cellule-hôte, et devraient susciter des développements dans l'élaboration de traitements pharmaceutiques plus efficaces.
Contact :
Pour obtenir de plus amples informations, n’hésitez pas à contacter le Docteur Thierry Soldati (Tél. ++41 22 379 64 96 / ++41 79 262 57 05).
Référence :
Infection by tubercular mycobacteria is spread by nonlytic ejection from their amoeba hosts, M. Hagedorn, K.H. Rohde, D.G. Russell, T. Soldati, Science 323 (5922), 1729-1733, (2009). DOI
Information supplémentaire :
- Vidéos sur le site de la Section de chimie et biochimie
- Le Dr Soldati donnera une conférence publique sur les amibes, dans le cadre du Tête-à-Têtes de Sciences Moléculaires organisé par la Section de chimie et biochimie mercredi 8 avril 2009, 16h, à Sciences II
2009
