1. Environnement en haute altitude
L'altitude peut se définir en haute altitude (1'500-3'500m), très haute altitude (3'500-5'500m) et altitudes extrêmes (plus de 5'500m) (Hackett et al, 1995). La pression atmosphérique diminue de manière logarithmique avec l'altitude. La baisse de la pression partielle d'oxygène, qui représente 21 % de la pression atmosphérique, se fait donc de manière similaire, ce qui provoque l'hypoxie. Comparée aux valeurs trouvées au niveau de la mer, la pression partielle d'oxygène diminue de moitié à 5'500m, et n'en vaut plus que le tiers au sommet de l'Everest (8'848m). Signalons que la relation entre la pression atmosphérique et l'altitude varie en fonction de la latitude, de la saison, des conditions météorologiques et de la température. En effet, à altitude égale, la pression est plus basse en hiver, par mauvais temps, et si on s'éloigne de l'équateur. Le manque d'oxygène n'est pas le seul stress lié à l'altitude. Signalons les températures extrêmes, la sécheresse et les radiations solaires qui constituent d'autres dangers pour la santé.
2. Mécanismes d'adaptation
L'arrivée en altitude déclenche une série complexe d'ajustements physiologiques destinés à augmenter l'apport d'oxygène aux cellules et à augmenter leur tolérance à l'hypoxie.
1) Hyperventilation
Dès les premières heures passées en altitude, les chémorécepteurs carotidiens sensibles à la diminution de la PaO2 stimulent la ventilation (Bärtsch, 1992). L'importance de ce mécanisme, appelé réponse ventilatoire à l'hypoxie (RVH), dépend de facteurs génétiques et environnementaux. La RVH est notamment diminuée par l'alcool et les autres dépresseurs du système nerveux central. Elle est augmentée par la caféine et l'acétazolamide. Il semblerait qu'une bonne RVH améliore l'acclimatation et protège du MAM ainsi que de l' OEdème Pulmonaire de Haute Altitude (OPHA) (Richalet et al, 1989). Cette hyperventilation provoque une alcalose respiratoire, qui est compensée dans les 24 à 48 heures par une acidose métabolique d'origine rénale par perte de bicarbonates. La compensation peut être complète jusqu'à 5'000m environ, mais à plus haute altitude elle devient insuffisante et le pH sanguin devient de plus en plus alcalin.
2) Circulation
L'étape suivante du transfert d'oxygène se fait par la circulation. L'augmentation des catécholamines circulantes provoque une discrète et temporaire augmentation de la pression artérielle, ainsi qu'une augmentation modérée de la fréquence et du débit cardiaque (Samaja et al, 1997). Le volume d'éjection diminue à cause de la baisse du volume plasmatique (diurèse des bicarbonates, extravasation du liquide plasmatique). Ces valeurs se normalisent avec l'acclimatation, sauf aux altitudes extrêmes. L'hypoxie, entre autres, provoque une vasoconstriction des artérioles pulmonaires. Il s'ensuit une hypertension artérielle pulmonaire qui s'accentue encore avec l'effort. Cette hypertension cause une surcharge du coeur droit et on peut observer une déviation axiale droite sur l'ECG. Elle est réversible après retour en plaine ou administration d'oxygène. Cependant, après 2 à 3 semaines de stimulus hypoxique, on note une altération structurelle de la paroi vasculaire qui s'enrichit de cellules musculaires (Naeije, 1997). On retrouve ces changements chez les habitants des Andes, mais pas chez les Tibétains. Ceux-ci ne présentent pas d'hypertension pulmonaire et semblent donc particulièrement adaptés à l'altitude (Moore et al, 1992). Le débit cérébral est augmenté car la vasodilatation causée par l'hypoxie est plus marquée que la vasoconstriction due à l'hypocapnie (Larsen, 1992).
3) Gradient alvéolo-artériel
Ce gradient correspond à la différence de pression partielle d'oxygène entre les alvéoles pulmonaires et le sang artériel systémique. Il augmente avec l'altitude et l'effort. Plus il est élevé, moins l'échange gazeux est efficace, et plus le MAM est sévère (Sutton et al, 1976).
4) Sang
L'hypoxie provoque une augmentation du taux d'hématocrite, causée les 2-3 premiers jours par la diminution du volume plasmatique, puis après 4-5 jours par l'apparition de nouveaux globules rouges. La sécrétion d'érytropoïétine est perceptible après 2 heures de stimulus hypoxique déjà. Le taux d'hématocrite peut augmenter durant plusieurs semaines et ce en fonction de l'intensité du stimulus. L'effet négatif est l'augmentation de la viscosité du sang, avec un risque accru de thrombose. La concentration de l'hémoglobine augmente de manière exponentielle, puis linéaire et atteint un plateau après 6 semaines environ. Le meilleur compromis entre transport d'oxygène et viscosité semble se situer à une concentration d'hémoglobine de 18g/dl (Ward, p.168). La concentration d'hémoglobine retrouve ses valeurs originelles 6 semaines après le retour en plaine. De par la forme sigmoïde de la courbe de dissociation de l'hémoglobine, la saturation d'oxygène est préservée jusqu'à une altitude de 3'000m environ (Brunner, 1992). L'augmentation de 2,3-diphophoglycérate relâché par le globule rouge provoque un déplacement de la courbe vers la droite ce qui améliore la libération d'oxygène dans les tissus. Ce mécanisme est contrebalancé par l'alcalose (qui déplace la courbe vers la gauche) si bien qu'aux altitudes extrêmes où l'alcalose est marquée, la courbe est déplacée vers la gauche pour faciliter la captation d'O2 par les poumons (Samaja, 1997).
5) Tissus
Une augmentation de la densité capillaire dans les tissus pourrait y faciliter la diffusion d'oxygène (Oelz et al, 1986). L'oxygène est ensuite utilisé comme comburant par les mitochondries. Certaines études montrent une augmentation de leur nombre en altitude (Ou et al, 1970), alors que d'autres n'ont pas révélé un changement de leur densité (Oelz et al, 1986).
6) Sommeil
La perturbation du sommeil est bien connue en haute altitude. Une des caractéristiques la plus importante est la respiration périodique (Salvaggio et al, 1998). Elle se compose d'une alternance d'apnées et d'hyperpnées, avec comme conséquence fâcheuse une baisse de la saturation en oxygène durant les apnées, des réveils fréquents et une mauvaise qualité de sommeil. Au niveau de la mer, ce type de respiration survient durant l'endormissement. Sa fréquence augmente avec l'altitude, et diminue avec l'acclimatation ou la prise d'inhibiteur de l'anhydrase carbonique (acétazolamide) (Larson et al, 1992). Elle pourrait jouer un rôle dans la survenue de l'OPHA (Richalet, 1995).
7) Exercice
La consommation maximale d'oxygène (VO2 max.), et donc la capacité à produire un exercice physique intense, diminue avec l'altitude à raison de 10 % par 1'000m dès 1'500m. Au niveau de l'Everest elle n'est plus que de 20 à 25 % de celle du niveau de la mer (Richalet, 1989). Signalons que les personnes ayant une VO2 max. élevée au niveau de la mer ne sont pas forcément plus performantes que les autres lorsqu'elles sont en altitude.
8) Détérioration de l'organisme
Si l'on reste longtemps à des altitudes supérieures à 5'500m, il y a un risque de détérioration progressive avec faiblesse, léthargie, et perte de poids (Lobenhoffer et al, 1982). Ces signes peuvent apparaître dès 1750m chez des personnes ayant des problèmes pulmonaires chroniques. Cette détérioration augmente avec l'altitude. Dès 7'000 m l'acclimatation n'est plus possible et la mort survient à plus ou moins longue échéance.
3. Syndromes liés à l'altitude
Les maladies les plus importantes liées à l'altitude sont le Mal Aigu des Montagnes, l'Oedème Cérébral de Haute Altitude et l'Oedème Pulmonaire de Haute Altitude. Elles ont plusieurs caractéristiques en commun, notamment le fait d'apparaître durant les premiers jours d'ascension et d'être améliorées par la descente et/ou l'oxygène. Par ailleurs, leur survenue et leur sévérité dépendent de l'altitude atteinte, de la vitesse de progression ainsi que de facteurs personnels (Hackett et al, 1977). Néanmoins elles peuvent présenter des caractéristiques légèrement différentes comme nous allons le voir plus loin.
1) Mal Aigu des Montagnes
Les symptômes en sont le mal de tête, la fatigue, les vertiges, les nausées, l'anorexie, et les troubles du sommeil. Les signes comprennent une ataxie, des troubles mentaux, des oedèmes périphériques et des râles pulmonaires. Ces 2 derniers signes se retrouvent également chez les personnes asymptomatiques, mais sont plus fréquents chez les personnes malades (Hackett et al, 1979). La forme sévère comprend une ataxie marquée, et des troubles de la conscience (lassitude, irritabilité, confusion, voire coma). Sans traitement approprié, à savoir la descente immédiate, elle conduit à l'OCHA. L'évolution spontanée est favorable dans la plupart des cas, avec amendement des symptômes après 2 ou 3 jours d'acclimatation. Certaines personnes doivent cependant redescendre ou prendre un traitement médicamenteux. Le diagnostic différentiel comprend les infections virales, l'épuisement, la déshydratation et l'intoxication au monoxyde de carbone (cf. cuisine dans les tentes). Ces affections peuvent également potentialiser le MAM.
a) Diagnostic
Il est établi par l'anamnèse et l'examen clinique du patient (Maggiorini et al, 1998). Ceci n'est pas toujours facile à réaliser en pratique car la présence d'un médecin est nécessaire. Des systèmes de scores basés sur des questionnaires permettent une quantification des symptômes subjectifs ressentis par le patient :
-
L'Environmental Symptom Questionnaire (ESQ) a été introduit en 1979 par Sampson et Kobrick pour déterminer les réactions des patients dans différentes conditions environnementales comme l'altitude ou le froid (Sampson et al, 1983). Deux révisions (ESQ-II et ESQ-III) l'ont amélioré et il est à présent reconnu comme fiable pour déterminer la présence ou l'absence de MAM (Wright et al, 1985). Il comporte 65 questions dont 21 sont utiles pour déterminer le MAM.
-
Le Lake Louise Scoring System (LLSS), plus simple, car il ne comporte que 6 questions, résulte d'un consensus établi en 1991 (Bärtsch, 1993 ; Roach et al, 1993 ; Savourney et al, 1995 ; Maggiorini et al, 1998).
b) Physiopathologie
Plusieurs mécanismes sont en relation avec le MAM sans que leurs rôles respectifs soient parfaitement compris. Ces mécanismes sont une hypoventilation relative, une augmentation de la pression intracrânienne, une rétention et redistribution des liquides corporels, et des dysfonctions endothéliales :
-
Les personnes ayant une faible RVH sont plus susceptibles de développer un MAM (Richalet et al, 1989). Cette hypoventilation relative provoque une augmentation du débit cérébral (vasodilatation due à l'hypoxémie et à l'hypercapnie relative).
-
L'augmentation de la pression intracrânienne se voit dans les cas plus avancés de MAM. Le cerveau étant confiné dans une enveloppe rigide, la moindre augmentation de son volume crée une augmentation nette de la pression intracrânienne. Les caractéristiques morphologiques du crâne, et en particulier du canal spinal de certaines personnes permettent d'atténuer cette augmentation. Ceci pourrait expliquer en partie la sensibilité moindre des personnes plus âgées. (Hackett, 1999)
-
Les mécanismes de rétention liquidienne sont multifactoriels et complexes (Milledge, 1992). On note une redistribution des fluides vers l'espace intracellulaire. Certaines études ont montré une élévation du taux plasmatique et urinaire de vasopressine chez les personnes souffrant de MAM (Bärtsch, 1991), d'autres, une augmentation du système rénine-angiotensine-aldostérone (Bärtsch, 1992). Une augmentation de la stimulation sympathique, avec pour conséquence une diminution du flux sanguin rénal et donc du débit urinaire, pourrait également intervenir.
-
Enfin signalons que l'on trouve des dysfonctions au niveau de l'endothélium vasculaire avec une augmentation de sa perméabilité chez les personnes souffrant de MAM (relâchement de certaines cytokines et eicosanoïdes (Richalet et al, 1991)). Il est cependant difficile de déterminer si elles sont la cause ou la conséquence de la maladie.
c) Facteurs de risque
Le seul facteur de risque clairement établi est le fait d'avoir déjà souffert de MAM auparavant (Honigman et al, 1993). Cela reflète probablement une hypersensibilité innée de la personne. D'autres facteurs, comme la jeune âge (Hackett et al, 1976), l'obésité (Honigman et al, 1993), le sexe féminin (Honigman et al, 1993), le fait de souffrir d'une affection aiguë (Murdoch, 1995) et le manque de condition physique (Richalet et al, 1989) sont parfois évoqués, mais pas systématiquement. Signalons que le tabac (Yoneda et al, 1997) et l'asthme (Cogo et al, 1997) ne sont pas des facteurs de risque reconnus. Certaines caractéristiques physiologiques comme une faible réponse ventilatoire ou circulatoire à l'hypoxie (Richalet et al,1989) ou une saturation artérielle plus diminuée lors d'hypoxie (Roach et al, 1998) seraient des facteurs favorisants. Leur mise en évidence lors de tests pourrait être utile pour les alpinistes notamment, afin de prévoir le risque de MAM lors de leurs tentatives d'ascension.
d) Incidence
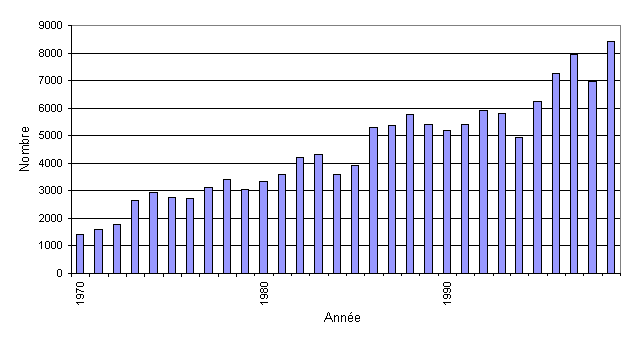
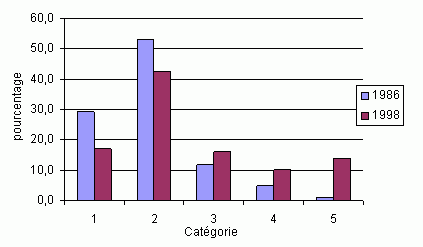
Elle varie en fonction de l'altitude et de la vitesse d'ascension. Elle passe de 18 à 20 % entre 2'000 et 3'000 m dans les montagnes du Colorado (Honigman et al, 1993), à 67 % pour les grimpeurs du Mont Rainier qui culmine à 4394m (Larson et al, 1982). Dans les Alpes suisses, elle fluctue entre 9 % à 2850m et 53 % à 4559m (Maggiorini et al, 1990).
e) Prévention
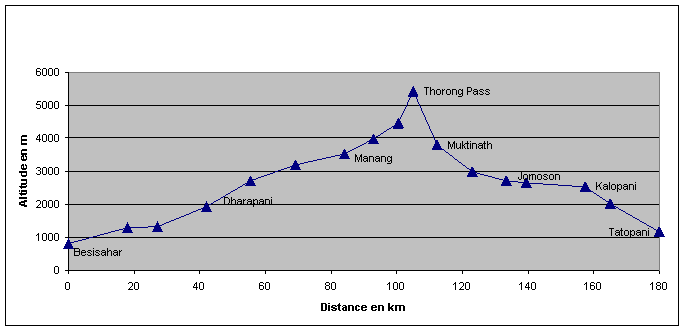
Une ascension progressive reste le meilleur moyen de prévenir le MAM (Hackett et al, 1978). Les recommandations d'usage préconisent de passer 2 nuits entre 2'500m et 3'000m, avec un gain journalier de 300 à 500m par la suite (Maggiorini, 1993). L'abstention d'alcool et d'autres médicaments sédatifs (somnifères) est recommandée en raison de l'effet négatif qu'ils causent sur la respiration périodique durant le sommeil. Théoriquement une augmentation du quotient respiratoire et une PaCO2 maintenue constante augmenterait la PaO2. Mais le rôle positif d'un régime riche en hydrates de carbones est controversé (Swenson et al, 1997). L'acétazolamide est bien connu pour ses propriétés préventives grâce à 4 mécanismes (Larson et al, 1982). Il produit une acidose métabolique par excrétion d'ions bicarbonates, il augmente la réponse ventilatoire à l'hypoxie, il diminue les périodes d'hypoxie extrême durant la respiration périodique du sommeil, et il diminue la rétention de fluides par son action diurétique. Sa prise est recommandée chez les personnes devant monter rapidement en dessus de 3'000m, et chez celles qui ont déjà présenté un MAM ou OPHA. Sa prise systématique n'est pas recommandée en raison des effets secondaires potentiels (paresthésies, nausées, allergie aux sulfamides). La déxaméthasone a également des vertus préventives (Ellsworth et al, 1991), mais elle n'est pratiquement jamais utilisée dans ce but pour des raisons bien évidentes liées au risque des corticoïdes en traitement chronique.
f) Traitement
Un MAM modéré devrait être traité par l'arrêt de l'ascension, avec éventuellement des analgésiques et de l'acétazolamide, ou par la descente d'environ 500m. Un MAM sévère implique une descente jusqu'à la disparition des symptômes (500 à 1'000m). Si ce n'est pas possible, il faut instaurer un traitement d'acétazolamide (Bradwell et al, 1992), de préférence avec de la déxaméthasone (Bernard et al, 1998), et éventuellement un apport d'oxygène, soit directement (Bärtsch et al, 1990), soit dans un caisson hyperbare (Bärtsch, 1992). Une règle d'or est de ne jamais dormir à des altitudes supérieures en présence de symptômes. Par ailleurs, si la symptomatologie s'aggrave malgré 24 heures d'acclimatation, il faut impérativement redescendre. Les indications à la descente immédiate sont la présence de troubles neurologiques (ataxie, changement de conscience) et/ou l'oedème pulmonaire.
2) OEdème Cérébral de Haute Altitude
Il survient généralement 1 à 3 jours après un MAM modéré, mais peut également se présenter brutalement. Ses signes principaux sont une ataxie, une lassitude sévère et des troubles de la conscience, mais il peut présenter le tableau de n'importe quelle pathologie neurologique courante (céphalées, nausées, hallucinations, hémiplégie, syndromes focaux). Le diagnostique différentiel comprend d'ailleurs de multiples pathologies neurologiques (accident vasculaire cérébral (AVC), accident ischémique transitoire (AIT), hémorragie cérébrale). La physiopathologie de l'OCHA consiste probablement en une progression des mécanismes du MAM. En règle générale, deux formes d'oedèmes cérébraux peuvent se rencontrer, l'oedème vasogénique et l'oedème cytotoxique. L'oedème vasogénique, interstitiel, présente un mécanisme similaire à celui de l'encéphalite hypertensive (Brunner, 1992). L'augmentation du débit cérébral provoque une augmentation de la pression au niveau des capillaires, et donc une extravasation de liquide. Il touche plus particulièrement la substance blanche, car celle-ci est moins dense que la substance grise, et donc plus facilement envahie par du liquide. C'est le seul oedème qui réponde aux stéroïdes. L'oedème cytotoxique, intracellulaire, est dû à un gonflement des cellules. Il touche plutôt la substance grise. En cas d'OCHA, il s'agit plus probablement du mécanisme vasogénique. (Hackett et al, 1998). La prévention est la même que pour le MAM, à savoir une montée progressive, l'abstention de dépresseurs du SNC, et un éventuel traitement d'acétazolamide. Le traitement comprend une descente la plus rapide possible, de la déxaméthasone, et de l'oxygène (direct ou via un caisson hyperbare). L'utilité des diurétiques est controversée.
3) OEdème Pulmonaire de Haute Altitude
Il peut se présenter avec ou sans signe de MAM (Bärtsch, 1993). Il apparaît généralement entre le 2e et le 4e jour, le plus souvent pendant la nuit. Les premiers symptômes sont une diminution des performances physiques et de la récupération. Puis apparaissent une toux, une dyspnée de repos, ainsi qu'une orthopnée. On peut observer une cyanose, de la fièvre, une tachycardie, une tachypnée, des râles crépitants et des expectorations rosées, voire sanglantes (Bärtsch, 1997). Le diagnostique est posé par la radio thoracique qui révèle un oedème pulmonaire interstitiel puis alvéolaire, avec une taille cardiaque normale et une distension des artères pulmonaires (Maggiorini et al, 1998). La résistance vasculaire pulmonaire est augmentée, et l'ECG montre des signes de surcharge ventriculaire droite. Signalons que sur 20 autopsies de personnes décédées d'OPHA, la moitié présentait des signes d'OCHA (Auerbach, p.21). La cause principale (mais non suffisante) est l'hypertension artérielle pulmonaire (Hultgren, 1997). A cela s'ajoute un trouble du rapport ventilation-perfusion avec l'apparition de zones hyperperfusées. Il est probable qu'une augmentation de la perméabilité capillaire , ainsi que des mécanismes inflammatoires entrent également en jeu. Les personnes habitant en hautes altitudes descendues en plaine, de même que celles qui ont déjà présenté un OPHA sont plus à risque de développer un OPHA lorsqu'elles remontent. Une diminution de la RVH (Richalet et al, 1989), le fait d'être un homme (Hultgren, 1997), ainsi qu'une prédisposition génétique concernant certains types HLA (Hanakoa et al, 1998) pourraient également jouer un rôle favorisant. L'incidence varie de 0.2% après 3±1 jours à 4'559 m dans les Alpes, à 15 % chez des soldats indiens arrivés en avion à 5'500m (Bärtsch, 1993). La prévention est identique à celle du MAM, avec en plus la nifédipine (20mg retard chaque 8 heures) chez les sujets ayant déjà souffert de l'OPHA. La nifédipine agit favorablement en diminuant l'hypertension artérielle pulmonaire et le gradient alvéolo-artériel (Oelz et al, 1992). Le traitement consiste à descendre immédiatement, mais il n'est pas toujours réalisable, et demande un effort physique important qui peut péjorer la situation. L'alternative consiste à donner de l'oxygène directement ou dans un caisson hyperbare, à réchauffer le patient car le froid complique la situation, et à donner un traitement médicamenteux de nifédipine (Hackett et al, 1992).
4) Autres pathologies liées à l'altitude
Il existe encore bien d'autres pathologies liées à l'altitude dont le développement dépasse les limites de ce traité. Mentionnons pour être complet les troubles de la coagulation, les oedèmes périphériques, la rétinopathie, l'immunosuppresssion, la maladie de Monge, et la kératite aux ultra-violets.
5) Contre-indications à aller en haute altitude
Les contre-indications absolues sont l'hypertension pulmonaire sévère, la broncho-pneumopathie chronique obstructive sévère (BPCO), l'anémie falciforme et l'insuffisance cardiaque décompensée. La BPCO modérée, l'insuffisance cardiaque modérée, les troubles d'apnée du sommeil, les arythmies, la coronaropathie stable, la grossesse à risque, les troubles cérébro-vasculaires ainsi que l'épilepsie non médicalisée imposent une certaine prudence. Enfin, signalons certaines pathologies courantes ne faisant pas courir de risque particulier en altitude, comme l'obésité, la sédentarité, le diabète, la BPCO discrète, l'asthme, la grossesse à faible risque, l'hypertension artérielle contrôlée, les troubles psychiatriques , ainsi que les pathologies néoplasiques et inflammatoires (Hackett et al, 1995) Il convient cependant d'évaluer la sensibilité individuelle de chaque personne ainsi que l'altitude projetée avant de prendre une décision.