Mise en évidence de l'ADN sur coupe paraffine par la réaction de Feulgen
Il s'agit d'une coloration de mise en évidence de l'ADN spécifique si elle est réalisée dans des conditions "contrôlées". La réaction de Feulgen est de loin la méthode cytochimique de coloration de l’ADN la plus largement utilisée et elle produit une excellente coloration de cette molécule. De plus il s'agit d'une méthode de choix pour le dosage d’ADN d' échantillons histologiques et cytologiques : coupes, frottis, noyaux isolés. La teneur en ADN est en effet essentielle pour le diagnostic & le pronostic des affections tumorales.
Microphotographie d'une portion de coupe paraffine longitudinale (8 μm d'épaisseur)
réalisée dans une racine primaire de Zea mays (zone méristématique; flèches rouges : mitoses).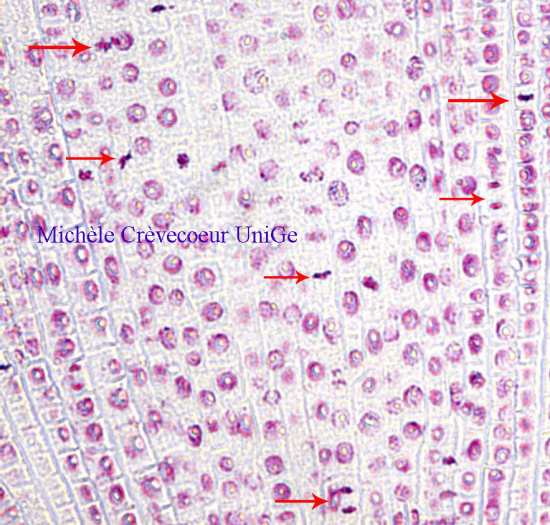
Protocole de la réaction de Feulgen sur coupes paraffine
Les coupes sont successivement :
- Déparaffinées
- Hydrolysées dans une solution d' HCl N à 60°C. Durée de l’hydrolyse à déterminer pour chaque fixateur et chaque tissu. Prévoir plusieurs temps et une coupe témoin non hydrolysée, maintenue dans de l’eau distillée à 60°C.
- Lavées à l’eau courante pendant 10 minutes.
- Colorées par le réactif de Schiff à l’abri de la lumière et de l’oxygène. La durée de la coloration varie en fonction du tissu et du fixateur. A titre d’indication pour des coupes d’embryons de maïs fixés au FAA et hydrolysées 12 minutes, le temps de coloration est de16 minutes pour un colorant neuf.
- Passées dans de l'eau sulfureuse pour enlever l'excès de colorant
- Rinçées à l'eau distillée.
- Eventuellement passées 5 à 10 min dans une solution de métabisulfite de sodium (NaHSO3) 2% pour s’assurer que le réactif de Schiff qui n’a pas réagi ne se retransforme pas en fuchsine colorée. et finalement montées entre lame et lamelle (Eukitt)
Principe de la réaction de Feulgen
La localisation, par le réactif de Schiff, de groupes aldéhydiques au niveau de l'ADN, implique le pré-traitement des coupes par une solution d'acide chlorhydrique N à 60°C pendant 10 minutes environ (ou 5 N pendant 20 minutes environ) à la température du labo. Cette hydrolyse acide modérée sépare les bases puriques de l'ADN des radicaux glucidiques (désoxyribose). Chaque radical désoxyribose toujours attaché à la chaîne phosphorée de l'ADN, laisse apparaître un groupe aldéhydique. La réaction est hautement spécifique de l’ADN mais pas de l’ARN qui ne se colore pas. L'intensité de l'hydrolyse est le facteur critique de cette réaction. Elle doit être suffisante mais ne pas excéder un optimum car alors l'ADN serait progressivement extrait des tissus. Cet optimum est à déterminer dans chaque cas. Une préparation témoin sans hydrolyse et d’autres contrôles doivent être prévus, pour s'assurer de la spécificité de la réaction. L’excès de colorant peut être enlevé par un rinçage dans une solution de métabisulfite de sodium pour éviter que le réactif de Schiff qui n’a pas réagi ne se transforme en fuschine colorée.