Recherche/Biologie
Le frein du ribosome
Des chercheurs du Département de biologie cellulaire montrent que la synthèse des protéines dans les cellules humaines doit être ralentie à un certain stade afin d’éviter des embouteillages aux conséquences potentiellement désastreuses
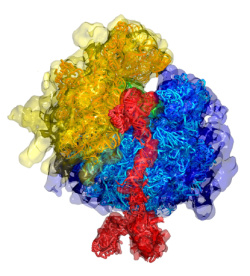
La fabrication des protéines dans les cellules humaines est réglée comme du papier à musique. Du gène à la molécule finale, chaque étape doit être franchie à son rythme, pas trop vite ni trop lentement, afin de ne pas perturber l’ensemble de l’opération et provoquer des embouteillages aux conséquences possiblement désastreuses. Dans un article paru dans la revue Cell du 2 mai, le groupe mené par Katharina Strub, professeure au Département de biologie cellulaire, a découvert un rouage supplémentaire dans cette gigantesque machinerie de régulation. Les chercheurs ont montré qu’une molécule appelée SRP (Signal Recognition Particle) freine considérablement la synthèse des protéines à un moment précis du processus. Ce ralentissement, qui va à première vue contre l’intérêt des cellules, permet en réalité d’optimiser le passage au stade suivant de la fabrication: l’entrée dans le réticulum endoplasmique, un compartiment intracellulaire où les protéines reçoivent, entre autres, leur forme définitive.
L’équipe genevoise (dont font aussi partie les doctorants Asvin Lakkaraju et Camille Mary ainsi que la laborantine Anne Scherrer) a identifié deux raisons à l’action de la SRP. La première est que, pour pénétrer dans le réticulum endoplasmique, la protéine naissante doit être très courte. Dès que son extrémité est engagée dans une des étroites portes d’entrée, la synthèse peut reprendre à vitesse normale, et la protéine est poussée à l’intérieur du compartiment. Si, au contraire, sa synthèse est déjà trop avancée, elle ne parvient plus à trouver le passage. Un peu comme un fil tenu trop loin de son extrémité et qu’on n’arrive pas à faire passer par le chas d’une aiguille.
La seconde raison est que les récepteurs situés à la surface du réticulum endoplasmique et qui sont spécifiques à la SRP ne sont pas assez nombreux pour intégrer en masse les protéines naissantes. La création d’une «salle d’attente» dans le cytoplasme permet ainsi de réguler le trafic, à l’image des feux rouges à l’entrée des grands axes menant au centre-ville. Il est possible, suggèrent les chercheurs, que cela assure du même coup une bonne fluidité dans la suite des opérations. Car, après l’entrée dans le réticulum endoplasmique, les protéines passent encore par plusieurs autres étapes (l’appareil de golgi, les lysosomes…) dont les capacités d’intégration sont peut-être elles aussi limitées.
«Toutes les protéines que fabrique la cellule commencent leur synthèse dans le cytoplasme (le liquide qui remplit les cellules), récapitule Katharina Strub. Et environ 30% d’entre elles passent obligatoirement par le réticulum endoplasmique avant d’arriver à leur destination finale qui se situe dans la cellule ou à l’extérieure de celle-ci. Il est donc capital que le mécanisme de pénétration dans ce compartiment, qui est d’ailleurs très sophistiqué, fonctionne sans erreur.»
La synthèse d’une protéine dans le cytoplasme est assurée par les ribosomes. Ces particules ribonucléoprotéiques lisent l’ARN messagers (qui contient l’information délivrée par le gène correspondant, situé dans les chromosomes du noyau cellulaire) et fabriquent en direct la protéine à l’aide des acides aminés flottant à proximité. Lorsque démarre la traduction, la chaîne naissante produite par le ribosome commence toujours par une «séquence signal», qui correspond à l’adressage de la protéine: ce petit segment d’acides aminés indique où la molécule devra être acheminée. La découverte dans les années 1970 de cette technique de signalisation a d’ailleurs valu le Prix Nobel de médecine à Günter Blobel en 1999.
Parfaitement étanche
Si la séquence signal est celle qui correspond au réticulum endoplasmique (c’est-à-dire dans 30% des cas), alors il est immédiatement reconnu par la SRP, présente en grand nombre dans le cytoplasme. Cette particule, de forme allongée, se lie alors à la fois à la séquence signal ainsi qu’au ribosome qui vient de la fabriquer (voir l’image ci-contre). Sa principale fonction est ensuite de s’amarrer à la membrane du réticulum endoplasmique. Une fois l’arrimage réalisé, la chaîne naissante de la protéine est engagée dans un pore hydrophile appelé translocon et le ribosome poursuit sa synthèse. Au fur et à mesure de sa croissance, la molécule pénètre ainsi dans son compartiment de destination. Le processus est parfaitement étanche et aucune autre substance que la protéine ne peut entrer dans (ou sortir du) le réticulum endoplasmique.
Le rôle de reconnaissance et de guide due la SRP est bien décrit dans la littérature scientifique. Ce qui est nouveau c’est son action sur la vitesse de synthèse du ribosome avant l’arrimage. «Nous savions depuis longtemps que la SRP pouvait arrêter l’élongation de la chaîne naissante, mais dans certains cas seulement, souligne Katharina Strub. Son influence sur la synthèse de la protéine et son passage dans le réticulum endoplasmique étaient donc encore incertains. Pour en avoir le cœur net, nous avons monté une expérience in vivo, sur des lignées de cellules humaines. Dans ce but, nous avons développé une forme légèrement mutée de la SRP, de manière à ce que tout fonctionne bien sauf la partie qui s’accroche au ribosome.»
Première observation: en présence de la SRP modifiée, le taux de protéines pénétrant dans le réticulum endoplasmique chute sévèrement. En ajoutant ensuite à leur expérience des substances connues pour freiner artificiellement la synthèse des protéines, ce taux revient progressivement à la normale. Par déduction, les chercheurs arrivent à la conclusion que la SRP (non modifiée) est un frein pour le ribosome. «S’il est libre, le ribosome synthétise des protéines à la vitesse moyenne de 8 acides aminés par seconde, précise Katharina Strub. Nous avons mesuré que la SRP divise cette valeur par quatre ou cinq.» Si la synthèse de la protéine n’est pas freinée de la sorte, elle ne peut entrer dans le réticulum endoplasmique et est immédiatement détruite par les enzymes présents dans le cytoplasme. «Un autre avantage de ce ralentissement, est qu’il permet sans doute une meilleure sélection des «bonnes» protéines admises dans le réticulum endoplasmique», poursuit Katharina Strub.
Une molécule remarquable
Le mécanisme précis par lequel la SRP freine le travail du ribosome est encore sujet à discussion. Beaucoup de spécialistes estiment que la particule bloque, par sa simple présence, un endroit du ribosome par lequel doivent arriver les acides aminés nécessaires à la fabrication des protéines. Katharina Strub n’y croit pas. «Dans notre expérience, la mutation que nous avons apportée à la SRP est mineure et ne change pas du tout sa structure spatiale, souligne-t-elle. Elle devrait donc fermer cette ouverture de la même manière que la SRP normale. Ce n’est manifestement pas le cas. En fait, je pense plutôt que c’est le contact précis entre la SRP et le ribosome qui modifie quelque chose dans cette dernière et l’empêche de travailler correctement. Comme si la SRP venait appuyer sur la pédale de frein du ribosome. Mais cela reste encore une hypothèse.»
La SRP est une molécule remarquable par le fait que sa structure est universelle: on la retrouve (au moins ses parties les plus importantes) à l’identique dans toutes les formes de vie de la planète, même séparées par des centaines de millions d’années d’évolution comme peuvent l’être une archéobactérie et l’être humain. Cette parfaite conservation à travers les âges témoigne de son importance pour la survie des cellules.
Mais cette particularité pourrait également ouvrir une porte à une application inattendue. Si l’on trouve la pédale de frein du ribosome chez les mammifères (ce qui n’est pas encore le cas), il n’est pas exclu que l’on trouve son équivalent, par homologie, chez les ribosomes des bactéries. Si les différences entre les deux sont suffisantes, il devient imaginable de développer une substance qui puisse activer cette zone artificiellement, freinant ainsi drastiquement la fabrication des protéines chez le microbe. En d’autres termes, cela représenterait un antibiotique d’une toute nouvelle génération.
Anton Vos
