Les cellules humaines peuvent aussi changer de métier
Des chercheurs de l’UNIGE démontrent la facilité de certaines cellules pancréatiques humaines à faire de l’insuline. Ce type de conversion cellulaire pourrait compenser, lors d’un diabète, la perte ou la dysfonction des cellules produisant naturellement cette hormone. Une première mondiale.
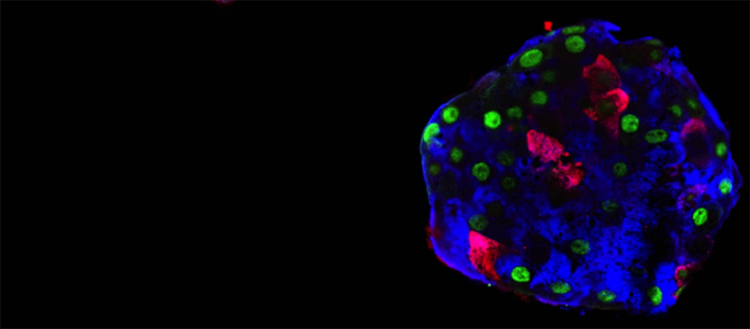
Pseudo-îlot constitué avec des cellules alpha humaines. Ces cellules produisent le glucagon (bleu), mais peuvent“apprendre” à faire de l’insuline (rouge). La protéine GFP (vert)permet de tracer l’origine des cellules, pour certifier leur changement d’identité. © Pedro Herrera, UNIGE
Les manuels de biologie nous apprennent que les cellules, une fois différenciées, restent figées dans l’identité qu’elles ont acquise. En incitant des cellules pancréatiques humaines non productrices d’insuline à modifier leur fonction pour fabriquer cette hormone de manière durable, des chercheurs de l’Université de Genève (UNIGE) démontrent pour la première fois que la capacité d’adaptation de nos cellules est bien plus grande qu’on ne le pensait. De plus, cette plasticité ne serait pas une exclusivité des cellules du pancréas humain. Une véritable révolution pour la biologie cellulaire, à découvrir dans la revue Nature.
Le pancréas humain abrite plusieurs types de cellules endocrines (α, β, δ, ε et ϒ) qui ont pour fonction de produire différentes hormones responsables de la régulation du taux de sucre dans le sang. Ces cellules sont agglomérées en petits amas nommés îlots pancréatiques ou îlots de Langerhans. Le diabète survient lorsque, en l’absence de cellules β fonctionnelles, le taux de sucre dans le sang n’est plus contrôlé. A la Faculté de médecine de l’UNIGE, le professeur Pedro Herrera et son équipe avaient déjà démontré, chez la souris, la capacité de régénération de nouvelles cellules à insuline par le biais d’un mécanisme spontané de changement d’identité d’autres cellules pancréatiques. Mais qu’en est-il de l’être humain? De plus, est-il possible de promouvoir cette conversion artificiellement?
D’une hormone à l’autre : un changement de longue durée
Pour vérifier si les cellules humaines disposent de cette capacité d’adaptation, les scientifiques genevois ont utilisé des îlots de Langerhans de personnes diabétiques et non diabétiques. Ils ont d’abord trié les différents types cellulaires pour en étudier deux plus particulièrement: les cellules α (productrices de glucagon) et les cellules ϒ (à polypeptide pancréatique). «Nous avons divisé nos cellules en deux groupes: l’un où nous n’avons introduit qu’un traceur cellulaire fluorescent, et l’autre où, en plus, nous avons ajouté des gènes produisant des facteurs de transcription de l’insuline, propres aux cellules β», explique Pedro Herrera.
Les chercheurs ont ensuite reconstitué des «pseudo-îlots», mais en n’agglomérant à chaque fois qu’un seul type de cellules afin d’observer précisément leur comportement. «Première observation: le simple fait d’agréger les cellules, même en pseudo-îlots monotypiques, stimule l’expression de certains gènes liés à la production d’insuline, comme si les cellules «non-β» détectaient naturellement l’absence de leurs «consœurs». Par contre, pour que les cellules se mettent réellement à produire cette hormone, nous avons dû stimuler artificiellement l’expression de ces gènes typiques des cellules β,» indique Kenichiro Furuyama, chercheur au Département de médecine génétique de la Faculté de médecine de l’UNIGE et premier auteur de ces travaux. Une semaine après le début de l’expérience, 30% des cellules α se sont mises à produire et sécréter de l’insuline en fonction des niveaux de glucose détecté. Les cellules ϒ, soumises au même régime, étaient encore plus efficaces et nombreuses à se reconvertir et à sécréter de l’insuline en réponse au glucose.
Dans un deuxième temps, les chercheurs ont transplanté chez des souris diabétiques ces pseudo-îlots monotypiques de cellules α humaines modifiées. «Les cellules humaines se sont montrées très efficaces. Nos souris ont guéri!» s’enthousiasme Pedro Herrera. «Et comme attendu, lorsque l’on ôtait ces greffes cellulaires humaines, les souris redevenaient diabétiques. Nous avons obtenu les mêmes résultats avec des cellules issues de personnes diabétiques comme non diabétiques, montrant ainsi que cette plasticité n’est pas endommagée par la maladie. De plus, cela fonctionne à long terme: six mois après leur transplantation, les pseudo-îlots de cellules α ainsi modifiées continuent à sécréter de l’insuline humaine en réponse au glucose élevé.»
Des cellules plus résistantes en cas de diabète auto-immun
Une analyse détaillée de ces cellules humaines à glucagon devenues productrices d’insuline montre qu’elles gardent une identité cellulaire proche de celle des cellules α. Le diabète auto-immun, ou diabète de type 1, est caractérisé par la destruction des cellules β par le système immunitaire des patients. Les chercheurs se sont alors demandés si ces cellules α modifiées seraient ciblées aussi par l’auto-immunité, puisqu’elles restent différentes des β. Pour connaître leur résistance, ils ont cultivé les cellules avec des lymphocytes T issus de patients souffrant de diabète de type 1. «Nous avons constaté que nos cellules α modifiées déclenchaient une réponse plus faible du système immunitaire, et donc pourraient être moins susceptibles d’être détruites que les cellules β natives.»
Aujourd’hui, la transplantation pancréatique est utilisée en cas de diabètes extrêmement graves, en transplantant soit le pancréas entier, soit de préférence uniquement les îlots pancréatiques, une approche beaucoup moins invasive. Très efficace, cette technique a néanmoins ses limites: comme toute transplantation, elle va de pair avec un traitement immunosuppresseur. Malgré cela, les cellules transplantées disparaissent au bout de quelques années. «L’idée d’utiliser les capacités intrinsèques de régénération du corps humain prend ici tout son sens,» souligne Pedro Herrera. Cependant, de nombreux obstacles restent encore à surmonter pour proposer un traitement issu de ces travaux, notamment financés par le NIH-NIDDK – l’Institut national du diabète, des maladies digestives et rénales, émanant des National Institutes of Health des Etats-Unis, par un subside d’excellence du Fonds national suisse de la recherche scientifique (FNS), et par la Fondation privée des HUG. «Il faut en effet trouver un moyen – pharmacologique ou par thérapie génique – de stimuler ce changement d’identité des cellules concernées à l’intérieur même du pancréas du patient, mais sans engendrer d’effets indésirables sur d’autres types de cellules,» ajoute-t-il. Le chemin sera difficile et long.
