Quand les cellules saines stimulent la migration des cellules tumorales
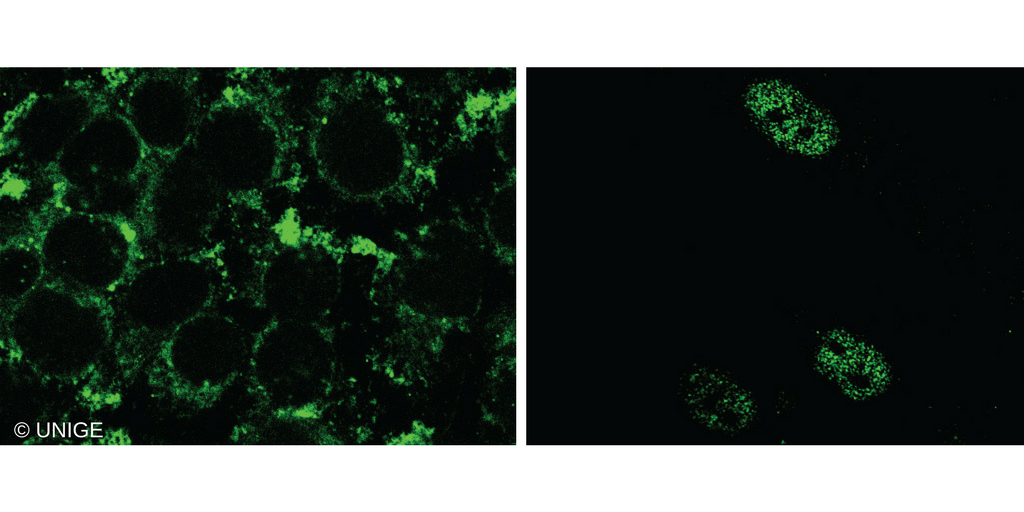
A gauche: cellules porteuses de GPER traditionnel (cytoplasme fluorescent). A droite: cellules porteuses du variant nucléaire de GPER (noyau fluorescent). © UNIGE
Les œstrogènes agissent comme des moteurs de croissance des cellules mammaires, tant saines que cancéreuses, en se liant à des récepteurs dont un type baptisé GPER est généralement localisé dans les membranes cellulaires. Des études récentes ont toutefois révélé la présence inhabituelle de ce récepteur dans le noyau des cellules de soutien – les fibroblastes – entourant les cellules tumorales mammaires. Des chercheurs de l’Université de Genève (UNIGE) ont découvert qu’il s’agissait d’une autre version de ce récepteur, un variant nucléaire de GPER, doté de propriétés différentes. Les fibroblastes porteurs de ce variant favorisent la migration des cellules malignes avoisinantes, participant ainsi au processus de métastatisation. Cette recherche, qui laisse entrevoir de nouvelles stratégies thérapeutiques, est à lire dans la revue Oncotarget.
Les œstrogènes jouent un rôle crucial dans la genèse de la majorité des cancers du sein, favorisant la survie, la prolifération et le comportement invasif des cellules tumorales. Ces hormones agissent en se liant à leurs récepteurs qui sont rassemblés en deux groupes, ER et GPER, dont les propriétés diffèrent.
L’équipe de Didier Picard, professeur au Département de biologie cellulaire de la Faculté des sciences de l’UNIGE, s’intéresse aux récepteurs GPER, dont les effets sur le cancer du sein sont moins connus que ceux de la famille ER. «En analysant une biopsie de tumeur mammaire, nos collègues de l’Université de Calabre, qui participent à cette étude, ont découvert des récepteurs GPER dans le noyau de fibroblastes présents autour des cellules malignes, alors qu’ils avaient toujours été localisés ailleurs auparavant», observe le biologiste.
Les fibroblastes abondent autour de la tumeur
Les fibroblastes, des constituants du tissu de soutien, font partie du microenvironnement des tumeurs. «Sachant que les cellules cancéreuses interagissent avec les cellules saines avoisinantes pour survivre et croître, nous avons voulu savoir si les récepteurs GPER observés dans le noyau de ces fibroblastes participaient à ce processus», explique Marco Pupo, premier auteur de l’étude.
Les chercheurs ont découvert l’existence d’une autre version de GPER: «Ce variant génétique résulte d’un changement minuscule, soit un seul nucléotide, dans le gène qui code pour le récepteur GPER. Cela suffit pour qu’il soit délocalisé vers le noyau. Nous avons détecté la présence de cette même version du gène dans les fibroblastes des huit autres biopsies que nous avons analysées, provenant des Hôpitaux Universitaires de Genève», détaille Didier Picard.
Le variant génétique de GPER pourrait prédisposer au cancer du sein
Le variant nucléaire acquiert également de nouvelles propriétés. En effet, contrairement au récepteur GPER décrit jusqu’alors, il est capable d’activer l’expression de gènes impliqués dans la croissance de tumeurs. Par ailleurs, les fibroblastes présents dans le microenvironnement tumoral et porteurs de GPER nucléaires sécrètent des molécules qui stimulent la migration des cellules cancéreuses mammaires avoisinantes.
«Nous avons déchiffré un élément important du dialogue qui s’établit entre les cellules malignes et les cellules saines adjacentes, et cherchons à connaître la nature des facteurs fibroblastiques impliqués dans le processus de métastatisation», précise Marco Pupo. Les regards se tournent désormais vers le GPER nucléaire et ses effets, qui pourraient devenir la cible d’un nouveau type de traitement.
Contact: Didier Picard, +41 22 379 68 13
15 juin 2017