Suivi de l’évolution des cellules neurogliaformes et leur rôle dans le microcircuit cortical

Étudier les interneurones de type neurogliaforme permet de réunir cinq éléments centraux des pathologies liées au stress : développement cérébral, cortex préfrontal, voie sérotoninergique, interneurones et plasticité. Voici pourquoi.
Le vécu modifie continuellement l’activité cérébrale et la structure des réseaux de neurones. Appelé plasticité dépendante de l’activité, c’est un processus essentiel à la mémoire et à l’apprentissage. Il est particulièrement prononcé au cours du développement, mais se poursuit tout au long de la vie. Les mécanismes de plasticité sous-jacents sont particulièrement intéressants pour Synapsy puisqu’ils sont impliqués dans la plupart des maladies psychiatriques. Le groupe d’Anthony Holtmaat à l’Université de Genève étudie les aspects fonctionnels et structurels de cette forme de plasticité neuronale alors que celui d’Alexandre Dayer cherche à savoir comment l’activité neuronale et la génétique peuvent altérer la trajectoire développementale des cellules neurales et ainsi modifier la connectivité des réseaux de neurones. Des approches complémentaires qui sont au centre d’un projet collaboratif entre les deux laboratoires impliquant Foivos Markopoulos, maitre assistant à l’Université de Genève. Il vise à comprendre comment un type d’interneurones appelé cellule neurogliaforme est impliqué dans les processus de plasticité.
La voie sérotoninergique pointée du doigt
Mais pourquoi étudier les cellules neurogliaformes en particulier ? La réponse provient des travaux de recherche du laboratoire d’Alexandre Dayer sur la sérotonine – neurotransmetteur impliqué dans des fonctions physiologiques comme le sommeil et l’humeur. Ces travaux indiquent qu’un dysfonctionnement de la voie sérotoninergique au cours du développement du cerveau affecte le développement des interneurones corticaux, dont les cellules neurogliaformes. En outre, les chercheurs genevois ont identifié qu’un récepteur à la sérotonine appelé HTR3A influence le développement des cellules neurogliaformes dans le cortex cérébral. Il est intéressant de noter que la variation du gène du récepteur HTR3A a été associée au PTSD étudié dans la cohorte clinique de Daniel Schechter (voir l’article "Exposition maternelle à la violence et psychopathologie des enfants"). De plus, des modèles animaux n’exprimant pas le gène du récepteur HTR3A sont incapables d’effacer leur peur, trait typique du PTSD.
Cap sur la mécanistique des circuits
Ces cellules neurogliaformes intriguent Foivos Markopoulos puisqu’elles ont été identifiées comme étant la source d’une forme d’inhibition lente à long terme, mais que « pour investir leur rôle dans la plasticité dépendante de l’activité, des outils sont nécessaires pour pouvoir les manipuler spécifiquement », raconte-t-il. Pour cette raison, il a développé avec ses collègues genevois Mathieu Niquille et Greta Limoni du laboratoire d’Alexandre Dayer, des outils génétiques pour tracer les origines des interneurones exprimant le récepteur HTR3A. Ces derniers ont découvert qu’un groupe spécifique de ces interneurones provenait d’une région différente des autres types d’interneurones, située à l’extérieur du cortex cérébral, dans la zone préoptique. De plus, ces cellules se déplacent sur de longues distances pour atteindre le cortex quelques jours après leur naissance et prennent plusieurs semaines pour arriver à maturité. En investissant leur profile électrophysiologique et morphologique, Foivos Markoupoulos a pu identifier que ces interneurones étaient en fait des cellules neurogliaformes corticales.
Grâce à ces informations et aux outils développés, Foivos Markopoulos entend désormais investir le rôle spécifique de ces cellules dans les mécanismes de plasticité dépendants de l’activité impliqués dans la mise en place des circuits neuronaux. Son objectif est de comprendre pleinement le rôle que jouent ces cellules dans l’apprentissage et le comportement et quelles sont les conséquences d’un dysfonctionnement de ces mécanismes dans le contexte des troubles liés au stress. « Nous nous concentrons sur la mécanistique des circuits qui impliquent ces cellules. Puisque l’activité des cellules neurogliaformes est susceptible de subir une régulation négative en cas d’exposition précoce au stress, il est très probable que cela déséquilibre leur fonction de modulation de l’activité synaptique, avec un impact sur la plasticité dépendante de l’activité », précise Foivos Markopoulos. ●
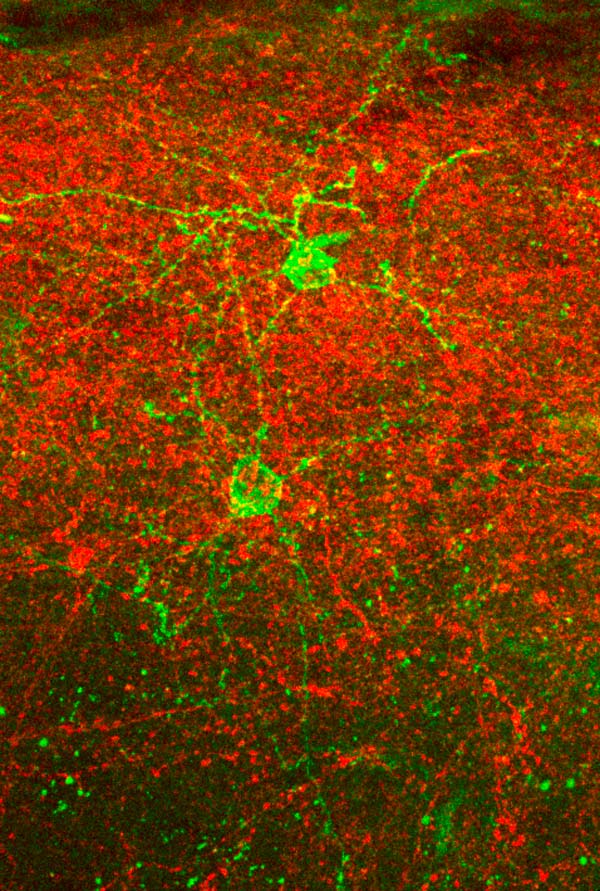
Cellules neurogliaformes (NGC, en vert) et axones du thalamus postéro-médial (en rouge) dans la couche 1 du barrel cortex de souris. Les deux types de cellules expriment des canaux ioniques permettant leur activation spécifique à l’aide de lumière pour étudier les connexions d’entrées et de sorties des NGC. © Foivos Markopoulos, laboratoire Holtmaat
10 mars 2020