De nouveaux outils de manipulation biologique
Ces vingt dernières années, la chimie a fourni de nombreux outils et techniques essentiels à la communauté biologique. Il est à présent possible de fabriquer des protéines auxquelles Mère Nature n’avait jamais pensé, capturer des parties uniques de cellules vivantes ou même observer des cellules chez des animaux vivants. Dans la revue d'ACS Central Science, trois équipes de recherche indépendantes de l’Université de Genève (UNIGE) et une équipe de l’Université de Bâle (UNIBAS) vont encore plus loin en annonçant des avancées dans la fabrication des protéines et dans l’observation de leurs schémas d’expression chez des animaux vivants.
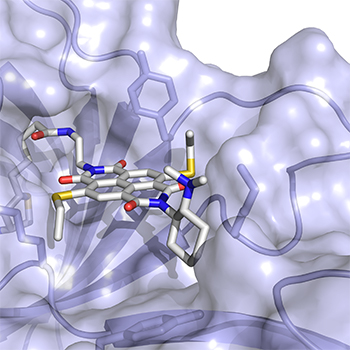
Situées au cœur des cellules, les protéines sont composées d’acides aminés qui se combinent entre eux pour former des machines fonctionnelles à l’origine des principaux processus cellulaires. Outre ces vingt acides aminés, les protéines contiennent des « cofacteurs » spéciaux, souvent des vitamines. Cependant, les chimistes ont découvert comment élargir le répertoire d’une protéine en fabriquant des acides aminés ou des cofacteurs différents de ceux disponibles dans la nature. Stefan Matile, du Département de chimie organique de la Faculté des sciences de l’UNIGE, Thomas Ward, du Département de chimie de l’UNIBAS, et leurs collaborateurs ont mis au point un nouveau cofacteur capable d’inverser une interaction protéique classique appelée cation-Π, à savoir la stabilisation d’une charge positive sur un plan moléculaire riche en électrons.
La nature utilise ces interactions cation-Π pour préparer des molécules aussi importantes que les stéroïdes, les hormones, les vitamines, les pigments visuels ou les fragrances, traduire des signaux dans le cerveau, reconnaître les antigènes, etc. En utilisant leur nouveau cofacteur et la protéine artificielle obtenue, les équipes de Matile et de Ward ont collaboré pour créer le premier enzyme « anion-Π », dans lequel ce plan moléculaire riche en électrons est remplacé par un plan pauvre en électrons afin de stabiliser une charge non plus positive mais négative pendant une transformation moléculaire. Des protéines dotées de cette nouvelle fonctionnalité, inédite dans la nature, ont réussi à faire mieux que les catalyseurs traditionnels. Les chercheurs estiment à présent que leur approche peut être transposée aux cellules et permettre ainsi de réaliser d’autres transformations chimiques actuellement impossibles.
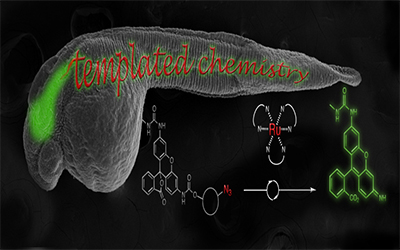
Par ailleurs, l’équipe de Nicolas Winssinger, du Département de chimie organique de la Faculté des sciences de l’UNIGE, a saisi l’opportunité d’utiliser des réactions chimiques pour visualiser l’ARN chez des animaux vivants. Toutes les protéines proviennent de l’ARNm, ces molécules qui transmettent l’information génétique de l’ADN au ribosome, en charge de la production de protéines. Ainsi, si l’ADN est le schéma de la vie, les ARNm donnent les ordres qui sont ensuite régulés par les micro-ARN. Le fait de pouvoir visualiser ce processus pourrait permettre d’en savoir beaucoup plus sur ce qu’il se passe dans les cellules chez les animaux en temps réel. Cependant, peu d’outils permettent actuellement d’observer l’ARN chez les animaux vivants et ceux qui existent utilisent généralement des stratégies génétiques complexes. Les équipes de Winssinger et de Marcos Gonzalez-Gaitan, du Département de biochimie de la Faculté des sciences de l’UNIGE, ont mis au point une réaction engendrée par l’appariement («template reaction») qui donne lieu à une fluorescence en présence d’ARN précis. Leur chimie est tellement peu invasive qu’elle fonctionne dans des embryons de poisson zèbre sans les perturber. De plus, étant donné qu’elle ne nécessite aucun organisme génétiquement modifié, elle peut rapidement être adaptée à d’autres systèmes vivants. Enfin, les chercheurs estiment que leur méthode pourrait être élargie à la théranostique (contraction de «thérapie et diagnostic»), permettant ainsi d’orienter les traitements sur une base moléculaire de la maladie.
Contact: Stefan Matile 022 379 65 19 Nicolas Winssinger 022 379 61 05
24 mai 2016