Mucoviscidose: pourquoi les infections persistent malgré la thérapie
Une équipe de l’UNIGE a découvert que le traitement contre la mucoviscidose n’élimine pas les points d’ancrage des bactéries responsables des infections respiratoires.
La mucoviscidose est une maladie génétique et héréditaire touchant des cellules spécifiques - les cellules épithéliales - tapissant certains organes, dont l'épithélium respiratoire dans nos poumons (encadré). © Adobe Stock - UNIGE
La mucoviscidose est une maladie génétique provoquant des dysfonctionnements respiratoires et digestifs graves, parfois mortels. Un nouveau traitement, disponible depuis 2020, améliore le fonctionnement des poumons et la qualité de vie des malades. Cependant, il n’élimine pas toujours les bactéries responsables d’infections respiratoires. En étudiant des modèles 3D de cellules issues de poumons humains, des scientifiques de l’Université de Genève (UNIGE) ont découvert que ce médicament n’empêche pas la formation, à la surface des voies respiratoires, de «points d’ancrage» auxquels les bactéries s’arriment pour infecter l’organisme. Ces points d’ancrage résultent d’une perturbation des signaux impliqués dans le développement des cellules du système respiratoire. En combinant le traitement actuel avec d’autres molécules, il serait possible de rétablir l’équilibre cellulaire et ainsi mieux prévenir les infections bactériennes. Ces résultats sont à découvrir dans la revue American Journal of Respiratory Cell and Molecular Biology.
La mucoviscidose est la maladie génétique la plus fréquente. Elle touche chaque année en Suisse un nouveau-né sur 3 300. Des mutations sur le gène responsable de la protéine CFTR provoquent la sécrétion d’un mucus trop épais qui obstrue les voies respiratoires. Si une trithérapie disponible depuis 2020 en Suisse permet d’améliorer la qualité de vie des malades, elle n’est pas adaptée à toutes les personnes touchées et ne s’avère pas toujours efficace.
«Une partie non négligeable des personnes sous ce traitement souffrent toujours d’inflammations et d’infections respiratoires. En comprendre la raison est essentiel afin d’améliorer la prise en charge des malades», explique Marc Chanson, professeur ordinaire au Département de physiologie cellulaire et métabolisme de la Faculté de médecine de l’UNIGE et membre du Centre de recherche sur l'inflammation de Genève, qui a dirigé ces travaux.
Un déséquilibre des signaux cellulaires
Lors de précédents travaux, l’équipe de Marc Chanson avait découvert que les cellules respiratoires atteintes de mucoviscidose construisent, à leur surface, des points d’ancrage permettant aux bactéries de se fixer solidement dans les poumons. «Nous avons donc voulu savoir si la trithérapie avait un effet sur ce mécanisme si favorable aux infections bactériennes», indique Mehdi Badaoui, maître-assistant au Département de physiologie cellulaire et métabolisme de la Faculté de médecine de l’UNIGE, dernier auteur de l’étude.
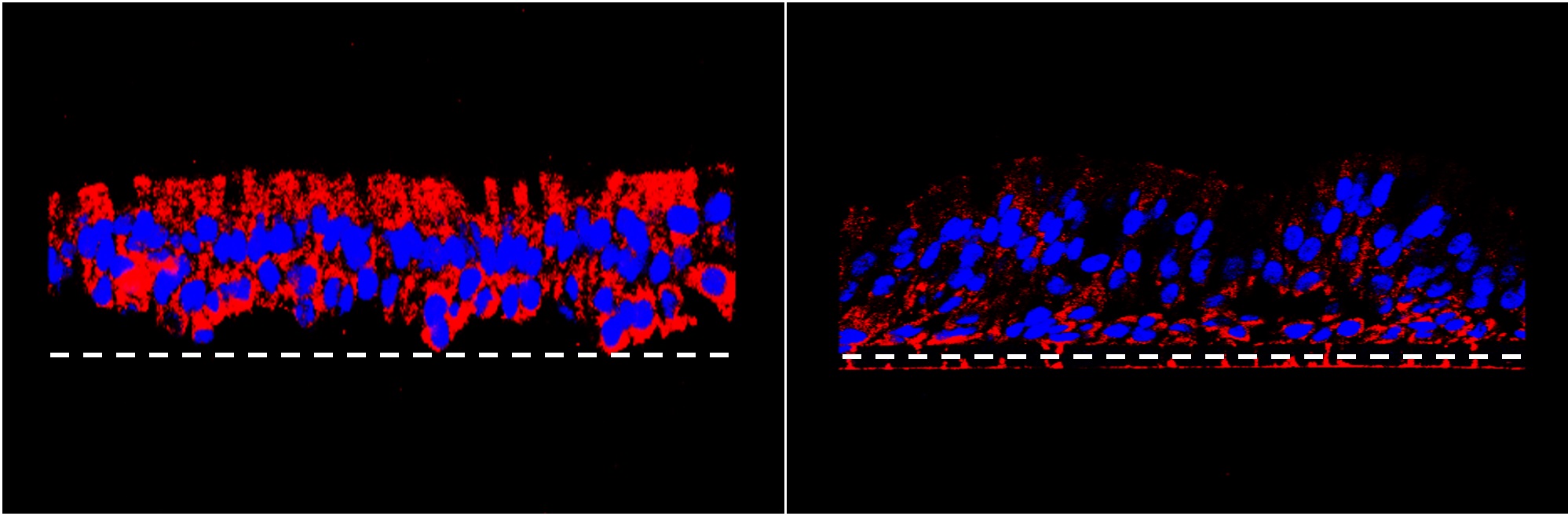
Les points d’ancrage présents à la surface des voies respiratoires en cas de mucoviscidose (image de gauche, en rouge) diminuent lors que l’équilibre entre les deux voies de signalisation cellulaire est restauré (image de droite).
En comparant des modèles 3D de cellules pulmonaires humaines — saines et atteintes de mucoviscidose — les scientifiques ont démontré que la trithérapie utilisée actuellement n’empêche pas la formation de ces stations d’ancrage. De plus, l’expression des gènes de cellules saines comparée à celle de cellules atteintes de mucoviscidose montre un déséquilibre entre deux voies de signalisation cellulaire: la voie TGF-β est hyperactivée, tandis que la voie Wnt est au contraire inhibée. Les voies de signalisation cellulaire sont à la base du développement de tout organisme pluricellulaire, humains compris. Sans elles, les cellules sont incapables de se développer et de fonctionner correctement.
En révélant une perturbation de ces voies de signalisation, l’équipe de recherche met en lumière un mécanisme clé: les cellules malades ne reçoivent pas les signaux adéquats, et créent alors ces stations d’ancrage qui leur sont pourtant néfastes. Pour preuve, en rétablissant l’équilibre entre ces deux voies de signalisation cellulaire, les scientifiques ont pu fortement diminuer la formation de ces points d’ancrage. «Si nous parvenions à identifier une molécule pharmaceutique capable de rétablir cet équilibre chez les malades, nous pourrions alors la combiner avec la trithérapie actuelle, pour en augmenter l’efficacité et ainsi limiter les infections bactériennes tout en diminuant ses effets secondaires», conclut Marc Chanson.
