Jauge à énergie des cellules béta & diabète
La protéine kinase activée par l'AMP, appelée AMPK, fonctionne comme un capteur de l'état énergétique des cellules β. Un apport énergétique élevé fourni par le glucose présent dans le sang désactive l'AMPK mais stimule la sécrétion d'insuline pour stocker les nutriments entrants. Intuitivement, l'activation de l'AMPK dans la cellule β ne devrait pas aller de pair avec l'action stimulante du glucose sur la sécrétion d'insuline, la première résultant d'un état énergétique faible et la seconde étant associée à une alimentation riche en énergie. Dans le diabète de type 2, les activateurs de l'AMPK tels que la metformine ont des effets bénéfiques, bien qu'ils devraient théoriquement réduire la sécrétion d'insuline et aggraver la situation.
Dans leur récente étude publiée dans le International Journal of Molecular Sciences, les chercheurs dugroupe du Prof. Pierre Maechler aidées des scientifiques du groupe du Prof. Mirko Trajkovski et de l'Université du Danemark du Sud ont découvert une explication potentielle pour cette contradiction. L'activation de l'AMPK pourrait mettre au repos les cellules β sur-sollicitées et améliorer l'état diabétique.
Cette collaboration entre deux groupes du Département de physiologie cellulaire et métabolismea permis une analyse approfondie de l'expression du gène AMPK en cas d'exposition chronique à différents sucres et acides gras, imitant les conditions diabétogènes. Si l'expression de l'AMPK n'était presque pas modifiée par ces différentes conditions diabétogènes, les régulateurs en amont (kinases) et les cibles en aval de l'AMPK se sont avérées significativement affectés comme visible dans la figure ci-dessous.
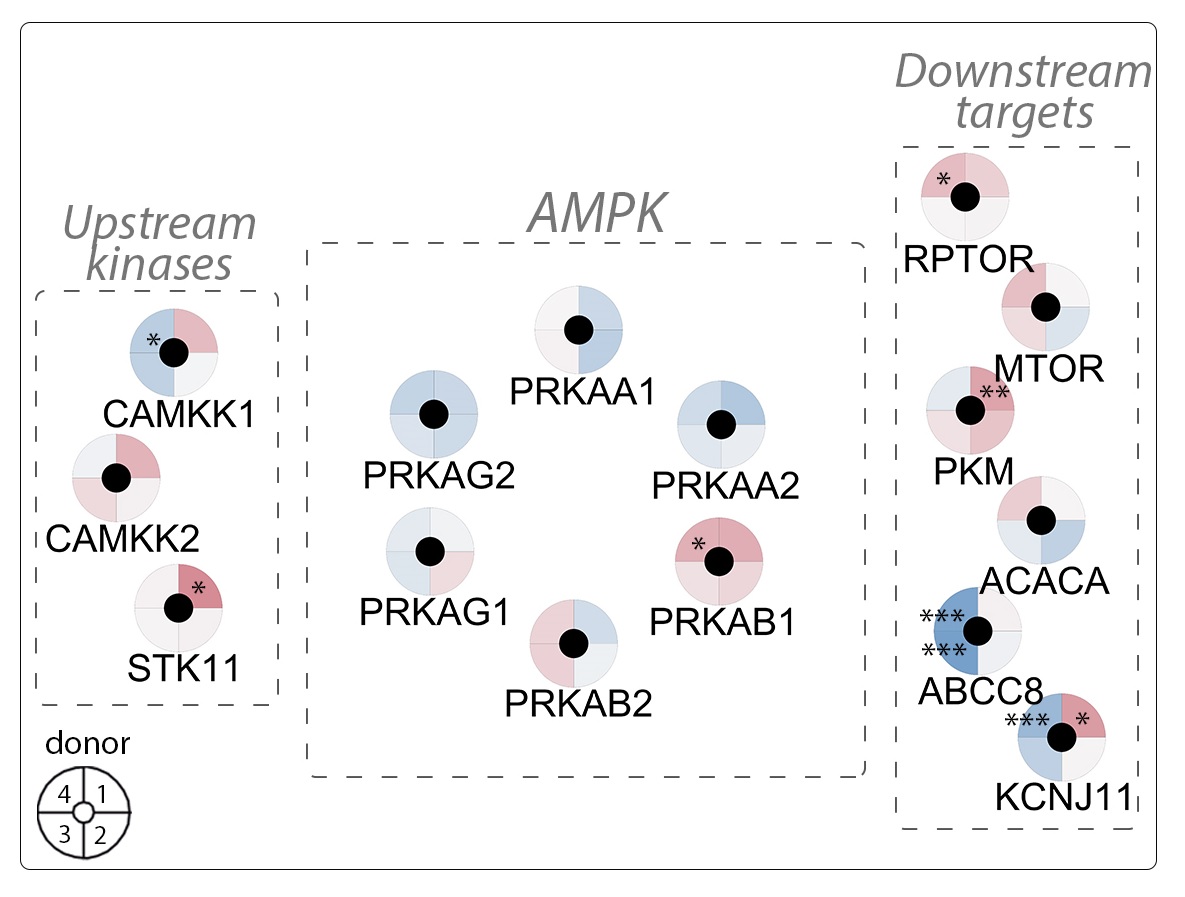
Niveaux d'expression de l'AMPK dans des îlots de Langerhans humains sous forte concentration en glucose (G25). Les régulations positives apparaissent en rouge et les régulations négatives en bleu. © adapté de la Figure 3 dans Brun et al. 2020 Journal of Molecular Sciences
22 juin 2020