Une IA pour prédire le risque de métastases des cancers
Des scientifiques de l’UNIGE ont développé un algorithme capable d’anticiper le risque de métastases et de récidives de cancers.
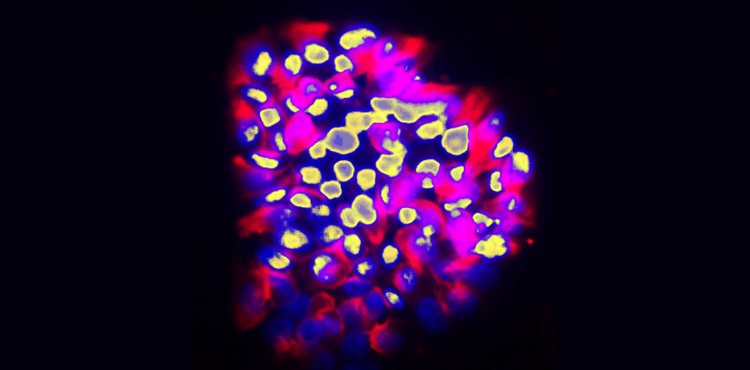
© Ariel Ruiz i Altaba, UNIGE. Cellules humaines de cancer du côlon au comportement invasif. Les noyaux des cellules sont en jaune et les corps cellulaires en rouge. Les protubérances en forme de doigts des cellules invasives sont dans la région supérieure.
Pourquoi certaines tumeurs se propagent-elles alors que d’autres restent localisées? Les mécanismes régissant le potentiel métastatique des cellules tumorales restent largement inconnus. Il s’agit pourtant d’une question cruciale pour optimiser la prise en charge des patientes et patients. À partir de cellules issues de tumeurs du côlon, des scientifiques de l’Université de Genève (UNIGE) ont d’abord identifié les critères influant sur le risque de métastases, puis des signatures d’expression génique permettant d’en évaluer la probabilité. L’équipe a ensuite créé un outil d’intelligence artificielle (MangroveGS) capable de transformer ces données en prédictions pour de nombreux cancers avec une fiabilité inégalée. Ces résultats, publiés dans Cell Reports, ouvrent la voie à une prise en charge plus précise et à la découverte de nouvelles cibles thérapeutiques.
«On impute souvent l’origine du cancer à des ''cellules anarchiques''», explique Ariel Ruiz i Altaba, professeur ordinaire au Département de médecine génétique et développement de la Faculté de médecine de l’UNIGE, qui a dirigé ces travaux. «Cependant, il faut plutôt comprendre le cancer comme une forme détournée du développement.» En effet, sous l’effet de changements génétiques et épigénétiques, des programmes supprimés pendant le développement de l’organisme et des tissus se réveillent pour donner naissance à une tumeur.
Ainsi, loin d’être un accident anarchique, le cancer répond à un programme ordonné. «Tout l’enjeu est donc de trouver les clés pour en saisir la logique et la forme. Et, dans le cas des métastases, d'identifier les caractéristiques des cellules qui vont se séparer de la tumeur pour en créer une autre ailleurs dans le corps.
Après entraînement, le modèle a atteint une précision proche de 80 % pour prédire la survenue de métastases et de récidives du cancer du côlon.
Traquer les cellules métastatiques
Les métastases restent la principale cause de mortalité dans la plupart des cancers, et notamment pour les cancers du côlon, du sein ou du poumon. À l’heure actuelle, le premier signe détectable du processus métastatique est la présence, dans le sang ou dans le système lymphatique, de cellules tumorales circulantes. Mais il est alors déjà trop tard pour empêcher leur dissémination. De plus, si les mutations qui entraînent la formation des tumeurs originelles sont bien comprises, aucune altération génétique unique ne peut expliquer pourquoi, de façon générale, certaines cellules migrent et d’autres non.
«La difficulté est de pouvoir détailler l’identité moléculaire complète d’une cellule — une analyse qui la détruit — tout en observant sa fonction, ce qui nécessite qu’elle reste vivante », explique le professeur Ruiz i Altaba. «Pour cela, nous avons isolé, cloné et cultivé des cellules tumorales», ajoute Arwen Conod, maître assistante au Département de médecine génétique et développement de la Faculté de médecine de l’UNIGE et co-première auteure de cette étude. «Ces clones ont ensuite été évalués in vitro et dans un modèle de souris pour observer leur capacité à migrer à travers un vrai filtre biologique et générer des métastases.»
L’analyse de l’expression de plusieurs centaines de gènes, réalisée sur une trentaine de clones issus de deux tumeurs primaires du côlon, a permis d’identifier des gradients d’expression génique étroitement liés à leur potentiel migratoire. Dans ce contexte, l’évaluation précise du potentiel métastatique ne dépend pas du profil d’une seule cellule, mais de la somme des interactions entre les cellules cancéreuses apparentées qui forment un ensemble.
Un algorithme de prédiction ultra-fiable
Les signatures d’expression génique obtenues ont été intégrées dans un modèle d’intelligence artificielle développé par l’équipe genevoise. «La grande nouveauté de notre outil, appelé ‘‘Mangrove Gene Signatures'' ou ''MangroveGS'', est d’exploiter des dizaines, voire des centaines de signatures de gènes. Cela le rend particulièrement résistant aux variations individuelles», explique Aravind Srinivasan, assistant au Département de médecine génétique et développement de la Faculté de médecine de l’UNIGE et co-premier auteur de cette étude.
Après entraînement, le modèle a atteint une précision proche de 80 % pour prédire la survenue de métastases et de récidives du cancer du côlon, un résultat bien supérieur aux outils déjà existants. De plus, les signatures dérivées du cancer du côlon peuvent également prédire le potentiel métastatique d’autres cancers, comme ceux de l’estomac, du poumon ou encore du sein.
Un pas important pour la clinique et la recherche
Grâce à MangroveGS, des prélèvements sur la tumeur suffisent: les cellules peuvent être analysées et leur ARN séquencé à l’hôpital, puis le score de risque métastatique rapidement transmis aux oncologues et aux patientes et patients depuis un portail Mangrove encrypté, chargé d'analyser les données anonymisées. «Cette information permettra d’éviter le surtraitement des malades à faible risque, limitant ainsi les effets secondaires et les coûts inutiles, tout en intensifiant la surveillance et le traitement de celles et ceux dont le risque est fortement élevé», ajoute Ariel Ruiz i Altaba. «Elle offre également la possibilité d’optimiser la sélection des participant-es aux essais cliniques, ce qui réduit le nombre de volontaires requis, augmente la puissance statistique des études, et apporte un bénéfice thérapeutique aux malades qui en ont le plus besoin.»
Ce travail a été réalisé notamment avec le soutien du Fonds national suisse (FNS), de la Fondation suisse de recherche sur le cancer et du DIP de l'État de Genève.
