15 février 2024 - Anton Vos
Un revêtement bactéricide contre la résistance aux antibiotiques
Une équipe interdisciplinaire a mis au point des matériaux innovants qui empêchent les bactéries pathogènes de s’installer sur des surfaces sensibles. Ce projet au large spectre d’applications industrielles vient de recevoir un soutien substantiel d’Innosuisse.
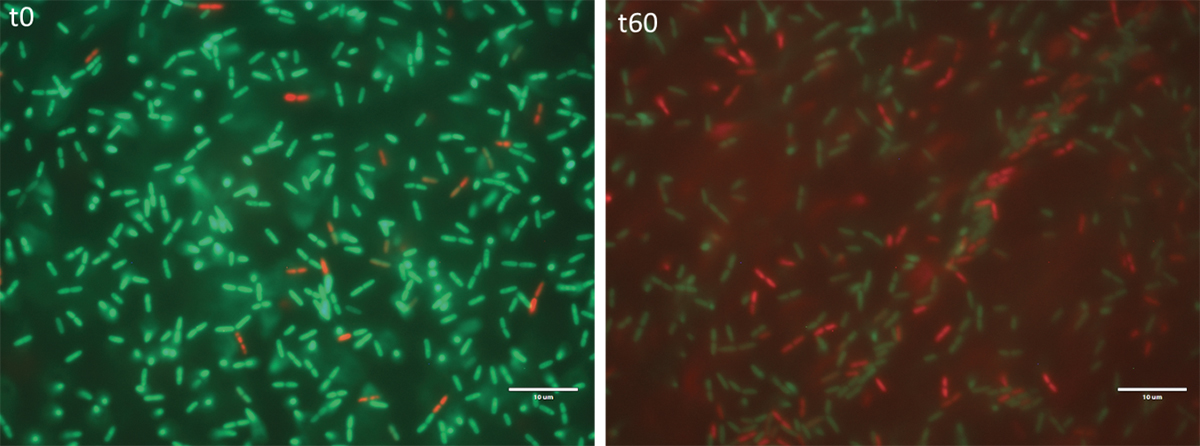
Colonie de bactéries sur un revêtement bactéricide immédiatement après leur dépose (à gauche) et une heure après (à droite). En vert les bactéries vivantes, en rouge les bactéries mortes. Image: UNIGE
Une des façons de lutter contre la prolifération des bactéries résistantes aux antibiotiques consiste à les empêcher de se déposer sur des surfaces stratégiques et de s’y reproduire tranquillement. C’est en tout cas le principe sur lequel s’appuie un revêtement bactéricide récemment mis au point par une équipe dirigée par Jorge Cors, chargé de mission au Département de physique de la matière quantique, et Karl Perron, chargé d’enseignement à l’Unité de microbiologie (Faculté des sciences). Composé d’alliages à base de titane et muni d’une structure invisible à l’œil nu, ce nouveau matériau a montré, selon ses concepteurs, une efficacité antimicrobienne spectaculaire contre les espèces responsables du plus grand nombre d’infections nosocomiales (c’est-à-dire survenant dans un milieu hospitalier), à savoir le staphylocoque doré, Escherichia coli et les salmonelles. Forte du résultat encourageant de cette approche, de sa mise en œuvre possiblement immédiate et de son grand potentiel de développement, l’équipe interdisciplinaire vient de décrocher une aide de plus de 600 000 francs sur dix-huit mois de la part d’Innosuisse, l’agence suisse pour l’encouragement de l’innovation, afin de poursuivre les études.
Un microscope devenu sertisseur
La technologie permettant de produire et de déposer le revêtement bactéricide (lire l’article principal) sur les surfaces métalliques est la même que celle qui est à l’origine d’une méthode de gravure microscopique sans bavure actuellement commercialisée par la start-up Phasis de l’Université de Genève, fondée et dirigée par Jorge Cors, chargé de mission au Département de physique de la matière quantique (lire aussi les articles dans Campus et le Journal de l’UNIGE). La technique est basée sur le microscope à effet tunnel, un appareil qui exploite une propriété de la physique quantique et qui est abondamment employé dans les laboratoires de physique. Muni d’une pointe extrêmement effilée circulant très près d’une surface sans jamais la toucher, cet instrument est capable de détecter et de manipuler – grâce à l’«effet tunnel», justement – des objets aussi minuscules que des atomes isolés.
Dans les années 2000, des scientifiques du Pôle de recherche national sur les matériaux aux nouvelles propriétés électroniques (MaNEP) ont réussi à détourner la fonction de base de cet appareil pour que, de microscope, il devienne graveur de métal et même sertisseur. En modifiant les paramètres électroniques (tension, courant, etc.) du microscope à effet tunnel tout en conservant sa précision, ils sont parvenus à faire en sorte que l’interaction (toujours sans contact) entre la pointe et la surface puisse faire fondre un métal et le moduler à l’échelle microscopique. Le dispositif peut ainsi creuser un trou, un sillon ou une petite surface dans le substrat métallique avec une précision incomparable – plus grande qu’avec un laser.
Le système a ensuite été perfectionné en baignant le dispositif pointe-surface dans un gel comportant un mélange de nanoparticules de différents métaux. La décharge électrique de la pointe, en plus de graver la surface, fait ainsi fondre la poudre métallique en suspension qui se dépose alors sous forme d’alliage. Il peut s’agir d’un alliage noble pour des applications dans l’horlogerie (décoration, poinçon de certification…) ou d’un matériau aux propriétés bactéricides.
-
Publié le
Prélever les champignons de la stratosphère pour prévenir les maladies fongiques

-
Publié le
En Israël et Palestine, nommer les lieux est lourd de sens

-
Publié le
En Afrique subsaharienne, les bactéries résistantes aux antibiotiques explosent

-
Publié le
Il y a 6000 ans, hommes et femmes étaient égaux face aux ressources

